题目内容
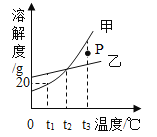
【题目】向盛有10g49%稀硫酸的烧杯中加入0.1mol的铁粉,充分反应后有固体残留,t1时迅速倒入一定量的硫酸铜溶液。整个过程烧杯中溶液的质量随时间的变化如图所示。分析错误的是( )
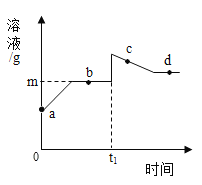
A. a→b点,溶液的pH逐渐增大
B. c点时,溶液中有两种溶质
C. d点固体,加入盐酸有气泡产生
D. m=12.7g
【答案】C
【解析】
解:0.1mol的铁粉即5.6g铁粉;
由方程式:
可知,向盛有10g49%稀硫酸的烧杯中加入5.6g克的铁粉,铁粉有剩余2.8g,在t1时迅速倒入一定量的硫酸铜溶液,铁与硫酸铜发生置换反应生成硫酸亚铁和铜单质,56g的铁置换出64g的铜单质,反应溶液的质量减小。
A、由上述分析和图象可知,a→b点,溶液的酸性减弱,其pH逐渐增大,不符合题意;
B、由图象可知,c点时溶液的质量还在减小,硫酸铜没有完全反应,溶液中溶质有硫酸亚铁和硫酸铜两种,不符合题意;
C、由于硫酸铜的量不能确定,可能有剩余的铁,d点时,烧杯中固体一定是有铜,可能有铁,加入盐酸不一定有气泡产生,符合题意;
D、设溶液的增量为x

![]()
解得:x=2.7g
所以m=10g+2.7g=12.7g,不符合题意。故选C。

【题目】银白色的金属钠是化学实验室中常见的药品,其化学性质十分活泼。某化学兴趣小组的同学,进行如下探究活动。
[查阅资料]
将一小块银白色的金属钠放置在空气中会发生下列变化:
钠![]() 钠的氧化物
钠的氧化物![]() 氢氧化钠溶液
氢氧化钠溶液![]() 白色固体
白色固体
[查阅资料]
A.钠的氧化物有氧化钠(Na2O)和过氧化钠(Na2O2),都能与水反应,反应化学方程式
如:Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
B.CaCl2溶液呈中性;碳酸钠溶液能与CaCl2溶液发生复分解反应;
C.碳酸钠溶液与盐酸反应方程式有:
Na2CO3 +HCl=NaHCO3 +NaCl(盐酸量不足)
Na2CO3+2HCl=2NaCl+H2O+CO2↑(盐酸量过量)
探究一:钠的氧化物是Na2O还是Na2O2 ?
(1)为检验常温下钠与氧气反应的产物,是Na2O还是Na2O2,完成实验方案:
选取试剂 | 实验现象 | 实验结论 |
__________ | __________ | 产物为Na2O |
探究二:白色固体是NaOH还是Na2CO3 ?
(2) 钠在空气中放置一段时间得到白色固体的成分
猜想1:Na2CO3 猜想2:NaOH 猜想3:Na2CO3和NaOH
[实验1] 取少量白色固体加水配成溶液,再滴入几滴稀盐酸,无气泡产生。
化学小组认为:据此现象,还不能得出猜想2成立。理由是________________。
[实验2] 化学小组进行如下实验
实验操作 | 实验现象 | 实验结论 |
①取少量白色固体配成溶液,加入足量______ | __________ | 猜想3成立 |
②过滤,取少量滤液滴入___________ | __________ |
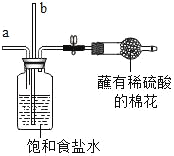
【题目】“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺,同学们查阅相关资料并进行模拟实验.
(查阅资料)
①生产原理:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(固体)↓+NH4Cl
②主要生产流程如图所示:
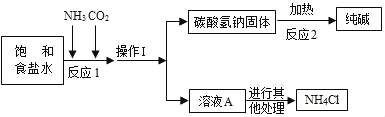
③氨气(NH3)是一种有刺激性气味的气体,极易溶于水,其水溶液显碱性.
(理论分析)
(1)依据资料①可知相同条件下,NaHCO3的溶解度_____NH4Cl的溶解度(填“>”或“<”).
(2)NaHCO3受热分解制得纯碱及两种常见的氧化物,该反应的化学方程式是_____.
(模拟实验)验证侯氏制碱法能获得纯碱
步骤 | 蘸有稀硫酸 实验装置 | 实验操作及现象 | 解释与结论 |
1 |
| 从a管通入NH3,一段时间后,从b管通入CO2,溶液中有固体析出 | (1)蘸有稀硫酸的棉花的作用是_____ (2)通NH3的a管若伸到液面下,会造成的后果是_____ |
2 |
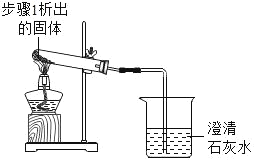
| 加热,导管口有气泡,澄清石灰水变浑浊 | 步骤1析出的固体是碳酸氢钠 |
3 |
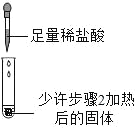
| 滴加足量稀盐酸,有气泡产生,固体逐渐消失 | 步骤2加热后得到的固体是纯碱 |
(实验反思)同学们认为步骤3的结论存在不足.依据题中信息,设计实验确定步骤2加热后得到的固体成分,其方案是_____.