题目内容
4.几位同学想制取一些FeCl3溶液,进行了如下实验:甲同学:将过量铁屑放入稀盐酸中,充分反应后过滤;
乙同学:将过量氧化铁粉末放入稀盐酸中,充分反应后过滤.
(1)甲同学获得溶液为浅绿色,所以大家一致认为这不是FeCl3溶液;
(2)乙同学所做实验中反应的化学方程式为Fe2O3+6HCl═2FeCl3+3H2O;
(3)甲同学所得溶液在空气中放置一段时间,溶液变黄,且有红褐色沉淀产生,这说明溶质跟O2、H2O发生了反应.
分析 (1)根据氯化铁溶液显黄色分析;
(2)根据氧化铁与盐酸反应生成氯化铁和水分析;
(3)根据质量守恒定律分析判断即可.
解答 解:(1)甲同学获得溶液为浅绿色,而氯化铁溶液显黄色,所以大家一致认为这不是氯化铁溶液;故填:浅绿;
(2)氧化铁与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O;故填:Fe2O3+6HCl═2FeCl3+3H2O;
(3)将过量铁屑放入稀盐酸中,盐酸充分反应.甲同学所得溶液是氯化亚铁,在空气中放置一段时间,溶液变黄,且有红褐色沉淀氢氧化铁产生,根据质量守恒定律可知,溶质跟氧气、水(只有水含有氢元素)发生了反应,故填:H2O.
点评 此题难度不大,掌握酸的化学性质、质量守恒定律以及化学方程式的书写方法等即可顺利解答.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
14.化学方程式是世界通用的化学语言,下列正确的化学方程式是( )
| A. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2↑+O2↑ | B. | BaCl2+Na2SO4=BaSO4↓+2NaCl | ||
| C. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | D. | 2Fe+3HCl=2FeCl3+H2↑ |
9.下列有关气体性质的描述正确且属于物理性质的是( )
| A. | CO2能还原铁矿石 | B. | O2具有可燃性 | ||
| C. | N2是无色有刺激性气味的气体 | D. | H2是最轻的气体 |
16.化学物质,很多是易燃、易爆、有腐蚀性或有毒的.如图所示图标不适合贴在装有鞭炮的箱子外面的是( )
| A. |  禁止烟火 | B. |  易燃物 | C. |  爆炸性 | D. |  腐蚀性 |
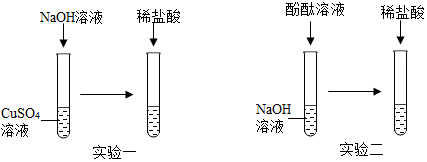
 (1)下列实验均涉及到水,其中水仅作为溶剂的是ACD;
(1)下列实验均涉及到水,其中水仅作为溶剂的是ACD;