题目内容
18.我们日常生活中离不开食盐,食盐的主要成分是氯化钠.
(1)如图1是钠元素和氯元素的原子结构示意图.下列说法不正确的是BD(填字母).
A、在化学反应中钠原子易失电子
B、氯原子的符号是Cl-
C、氯原子有三个电子层
D、氯化钠是有氯化钠分子构成的
(2)海水晒盐得到的粗盐中含有少量不溶性杂质(泥沙),还含有少量可溶性杂质(Na2SO4、CaCl2、MgCl2).现以粗盐为原料制取精盐,生产过程如图2所示.
①加入过量BaCl2溶液的目的是除去全部Na2SO4.
②写出NaOH与杂质反应的化学方程式MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
③操作Ⅰ和Ⅲ顺序不能颠倒,原因是颠倒后无法除去过量的BaCl2.
④加适量稀盐酸的作用是除去过量的碳酸钠和氢氧化钠.
(3)用提纯后的食盐配制一定质量分数食盐水,若用量筒量取水时俯视读数,则所配制溶液的溶质质量分数偏大(选填“偏大”、“偏小”或“不变”).
(4)某同学想测定所配制氯化钠溶液的溶质质量分数.取100g氯化钠溶液,加入足量的硝酸银溶液,生成14.35g沉淀.试计算氯化钠溶液的溶质质量分数.(精确到0.01%)
分析 (1)根据原子结构示意图的意义、元素的性质与原子的最外层电子数目的关系分析判断;
(2)①根据硫酸钠与氯化钡反应生成了硫酸钡沉淀和氯化钠分析加入过量氯化钡溶液的目的;
②根据NaOH与氯化镁的反应写出除杂质反应的方程式;
③根据碳酸钠能与氯化钡反应分析操作Ⅰ和Ⅲ顺序不能颠倒的原因;
④根据溶液中含有过量碳酸钠和氢氧化钠分析加入稀盐酸的目的.
(3)根据用量筒量取水时俯视读数是读数大于实际数分析;
(4)根据氯化钠与硝酸银的反应,由沉淀的质量计算参加反应的氯化钠的质量,即可计算出氯化钠溶液的溶质质量分数.
解答 解:(1)A、由于钠原子最外层的电子数是1,小于4,在化学反应中钠原子易失电子,故A正确;
B、氯原子的符号是Cl,故B错误;
C、氯原子有三个电子层,故C正确;
D、氯化钠是有氯离子和钠离子钠构成的,故D错误.
(2)①由于海水中含有硫酸钠,加入过量BaCl2溶液的目的是除去全部Na2SO4.
②由于氯化镁能与氢氧化钠反应,NaOH与杂质反应的化学方程式式:MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
③操作Ⅰ和Ⅲ顺序不能颠倒,原因是:颠倒后无法除去过量的BaCl2.
④加适量稀盐酸的作用是除去过量的碳酸钠和氢氧化钠.
(3)用提纯后的食盐配制一定质量分数食盐水,若用量筒量取水时俯视读数,读数大于实际数,实际量取的水偏少.则所配制溶液的溶质质量分数偏大.
(4)设生成14.35g沉淀,所需氯化钠质量为x
NaCl+AgNO3═AgCl↓+NaNO3,
58.5 143.5
x 14.35g
$\frac{58.5}{143.6}=\frac{x}{14.35g}$ 解得:x=5.85g,
氯化钠溶液的溶质质量分数=$\frac{5.85g}{100g}×100%$=5.85%
故答案为:(1)A;
(2)①除去全部Na2SO4;
②2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
③颠倒后无法除去过量的BaCl2;
④除去过量的碳酸钠和氢氧化钠;
(3)偏大;
(4)氯化钠溶液的溶质质量分数5.85%
点评 本题考查了原子结构示意图的意义,粗盐的提纯及除杂质的方法,盐的性质等,是一道综合性的题目.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| A. | 用过量CuSO4溶液除去铜粉中混有的少量铁粉 | |
| B. | 用点燃方法除去CO2中混有的少量CO | |
| C. | 用加熟石灰研磨的方法鉴别硝酸铵和硝酸钾 | |
| D. | 用燃烧法鉴别羊毛绒与棉线 |
| A. |  称量氯化钠 | B. |  测定溶液pH | C. |  量取9.0mL液体 | D. |  滴加液体 |
| A. |  无轨电车 | B. |  柴油汽车 | C. |  天然气汽车 | D. |  氢气汽车 |
| A. | 氯气溶于水时发生了化学变化 | |
| B. | 液氯与氯水一样都具有酸性 | |
| C. | 往氯水中滴加碳酸钠溶液会有气泡生成 | |
| D. | 往氯水中滴加硝酸银溶液后有白色沉淀产生 |
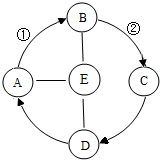 A、B、C、D、E是初中化学常见的五种物质,A、B、C、E物质类别分别属于氧化物、酸、碱、盐中的一种.化学兴趣小组同学设计了如图所示的各物质间关系,箭头表示一种物质可以转化成另一种物质,短线表示相连两种物质会发生化学反应(部分反应物、生成物以及反应条件省略).若A是食品干燥剂的一种,C和D的物质类别相同且C为D与E的反应产物之一,E的浓溶液有挥发性,①和②的转化过程为放热反应.则
A、B、C、D、E是初中化学常见的五种物质,A、B、C、E物质类别分别属于氧化物、酸、碱、盐中的一种.化学兴趣小组同学设计了如图所示的各物质间关系,箭头表示一种物质可以转化成另一种物质,短线表示相连两种物质会发生化学反应(部分反应物、生成物以及反应条件省略).若A是食品干燥剂的一种,C和D的物质类别相同且C为D与E的反应产物之一,E的浓溶液有挥发性,①和②的转化过程为放热反应.则 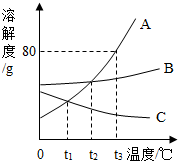 如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:
如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题: