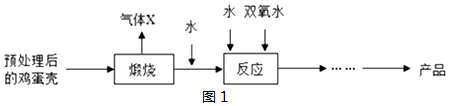
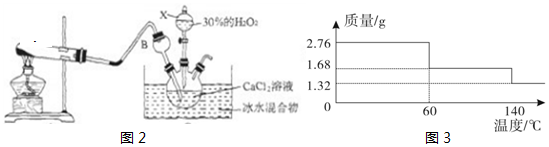
题目内容
7.某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水蒸气都是可再生能源;③溶液都能够导电;④不锈钢和目前流通的硬币都是合金;⑤推广使用无氟冰箱可防止“臭氧层空洞”;⑥纯碱和烧碱都是碱.其中说法完全正确的是( )| A. | ①③④⑤ | B. | ①④⑤⑥ | C. | ③⑤⑥ | D. | ①④⑤ |
分析 粗盐和酸雨等物质中含有多种物质;水蒸气不是能源物质;乙醇燃烧时能生成大量的二氧化碳;溶液不一定能够导电;合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的物质;氟利昂能够破坏臭氧层;纯碱是由金属离子和酸根离子组成的化合物,属于盐.
解答 解:①粗盐中含有氯化钠和泥沙等物质,属于混合物,酸雨中含有水、亚硫酸或硫酸等物质,属于混合物,故正确;
②水蒸气不是能源物质,故错误;
③溶液不一定能够导电,例如蔗糖水不能导电(没有自由移动的电荷),故错误;
④不锈钢和目前流通的硬币都是合金,故正确;
⑤氟利昂能够破坏臭氧层,推广使用无氟冰箱可防止“臭氧层空洞”,故正确;
⑥纯碱是由金属离子和酸根离子组成的化合物,属于盐,故错误.
故选D.
点评 解答本题要掌握物质的分类方法、能源与环境等方面的内容,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
相关题目
11.下列有关合金的说法错误的是( )
| A. | 生铁是一种铁的合金 | B. | 黄铜的硬度比纯铜的硬度大 | ||
| C. | 钢是一种化合物 | D. | 焊锡的熔点比纯锡的熔点低 |
18.如表列出了除去物质中所含少量杂质的方法,其中错误的是( )
| 选项 | 物质 | 杂质 | 除杂方法 |
| A | CO2 | CO | 点燃 |
| B | MnO2粉 | C粉 | 在空气中充分灼烧 |
| C | FeSO4溶液 | CuSO4溶液 | 加入足量的铁粉,过滤 |
| D | NaCl固体 | 泥沙 | 溶解、过滤 |
| A. | A | B. | B | C. | C | D. | D |
2.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )


| A. | 甲的溶解度大于乙 | |
| B. | 50℃时,将25g乙加入50g水中,可形成75g溶液 | |
| C. | 将50℃时甲的溶液降温至40℃,一定会析出晶体 | |
| D. | 将60℃的甲、乙、丙三种物质的饱和溶液降温至0℃,所得溶液中溶质质量分数由大到小的顺序为乙>甲>丙 |
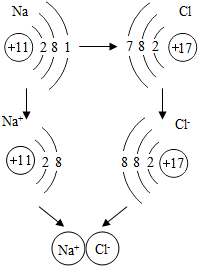 如图是金属钠与氯气反应生成氯化钠的微观示意图,根据图示回答下列问题.
如图是金属钠与氯气反应生成氯化钠的微观示意图,根据图示回答下列问题.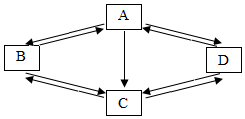 已知A、B、C、D是初中化学中常见的物质.它们之间的部分转化关系如图所示(图中反应条件及部分反应物、生成物已省略).A是一种温室效应的主要气体,B是单质.D在常温下不稳定易分解.
已知A、B、C、D是初中化学中常见的物质.它们之间的部分转化关系如图所示(图中反应条件及部分反应物、生成物已省略).A是一种温室效应的主要气体,B是单质.D在常温下不稳定易分解. 往100g含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:
往100g含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算: