题目内容
18.下列离子在pH=2的无色溶液中能大量共存的是( )| A. | K+、SO42-、Cl-、H+ | B. | OH-、CO32-、K+、Ca2+ | ||
| C. | Na+、SO42-、OH-、NO3- | D. | Na+、Cu2+、Fe3+、NO3- |
分析 pH为2的水溶液显酸性,水溶液中含有大量的H+;根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能大量共存,据此进行分析判断即可.本题还要注意溶液呈无色,不能含有明显有颜色的铜离子、铁离子和亚铁离子等.
解答 解:pH为2的水溶液显酸性,水溶液中含有大量的H+;
A、四种离子间不能结合成沉淀、气体或水,能在酸性溶液中大量共存,且不存在有色离子,故选项正确.
B、OH-、CO32-与酸性溶液中的H+分别能结合成水、水和二氧化碳,不能大量共存,故选项错误.
C、OH-与酸性溶液中的H+能结合成水,不能大量共存,故选项错误.
D、四种离子间不能结合成沉淀、气体或水,且能在酸性溶液中大量共存,但Cu2+、Fe3+的水溶液分别呈蓝色、黄色,故选项错误.
故选:A.
点评 本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水;还要注意是在酸性溶液中共存及特定离子的颜色.

练习册系列答案
相关题目
8.下列有关实验现象的描述不正确的是( )
| A. | 镁条和稀盐酸反应,放出热量 | B. | 铁丝在氧气中燃烧,生成白色固体 | ||
| C. | 红磷在空气中燃烧,产生大量白烟 | D. | 铁粉和稀盐酸反应,产生无色气泡 |
9.苯(C6H6)是重要的化工原料.下列叙述正确的是( )
| A. | 苯属于有机物 | B. | 78g苯中含碳元素36g | ||
| C. | 苯中C和H元素的质量比是1:1 | D. | 苯由6个碳原子和6个氢原子构成 |
6.下列图示的实验操作中不正确的是( )
| A. |  闻气体气味 | B. |  称固体质量 | ||
| C. |  读液体体积 | D. |  点燃酒精灯 |
13.根据下面实验内容和实验现象推出的结论中,不正确的是( )
| 实验内容 | 实验现象 | 实验结论 | |
| A | 高温下,将一氧化碳通过氧化铁粉末 | 红色粉末变为黑色 | 一氧化碳具有还原性 |
| B | 将二氧化碳通入紫色石蕊溶液中 | 紫色石蕊溶液变红色 | 二氧化碳显酸性 |
| C | 某气体通入澄清石灰水 | 出现白色浑浊 | 该气体可能是CO2 |
| D | 某溶液中滴入氯化钡试剂 | 有白色沉淀 | 该溶液中可能含有CO32-SO42-或Ag+等离子 |
| A. | A | B. | B | C. | C | D. | D |
3.下列物质中属于纯净物的是( )
| A. | 空气 | B. | 液氧 | C. | 生铁 | D. | 粗盐 |
10.分析推理是化学学习中常用的思维方法,下列推理正确的是( )
| A. | 中和反应有盐和水生成,所以生成盐和水的反应一定是中和反应 | |
| B. | 燃烧都伴随着发光、放热现象,所以有发光、放热现象的变化就是燃烧 | |
| C. | 碱性溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液一定是碱性溶液 | |
| D. | 化合物是由不同种元素组成的物质,所以由不同种元素组成的物质一定是化合物 |
7.下列实验操作正确的是( )
| A. |  滴加液体 | B. |  稀释浓硫酸 | C. |  检查气密性 | D. |  测定溶液pH |
10.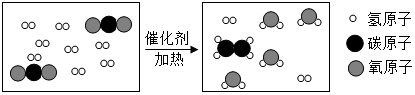 科学家采用“组合转化”技术,可将二氧化碳在一定条件下转化为重要的化工原料乙烯,其反应的微观过程如图所示.下列说法不正确的是( )
科学家采用“组合转化”技术,可将二氧化碳在一定条件下转化为重要的化工原料乙烯,其反应的微观过程如图所示.下列说法不正确的是( )
 科学家采用“组合转化”技术,可将二氧化碳在一定条件下转化为重要的化工原料乙烯,其反应的微观过程如图所示.下列说法不正确的是( )
科学家采用“组合转化”技术,可将二氧化碳在一定条件下转化为重要的化工原料乙烯,其反应的微观过程如图所示.下列说法不正确的是( )| A. | 参加反应的两种分子的个数比是1:4 | |
| B. | 反应中没有单质生成 | |
| C. | 反应前后原子种类、数目均不变 | |
| D. | 乙烯的化学式为C2H4 |