题目内容
17.从海水中得到的粗盐,往往含有可溶性杂质(主要有CaC12、MgCl2、Na2SO4)和不溶性杂质(泥沙等),必须进行分离和提纯后才能用于工业生产和人们的日常生活,粗盐提纯的部分流程如图: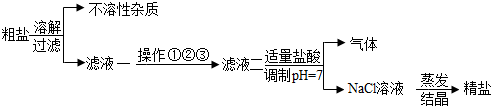
其中,滤液一至滤液二之间需进行三步操作:
操作①:加入过量的X,除去滤液中的SO42-
操作②:加入过量的NaOH,除去滤液中的Mg2+
操作③:加入过量的Na2CO3,除去滤液中的Ca2+
请回答:
(1)操作①中的物质X的化学式为NaOH;为最终获得精盐,操作①、②和③后还需增加的实验操作名称是过滤.
(2)滤液二中加入适量稀盐酸的目的是为了除去操作②、③中加入的过量NaOH和 Na2CO3,写出此步骤中发生反应的化学方程式:HCl+NaOH═NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑.
分析 (1)根据除杂质的注意事项:加入的试剂只能与杂质反应,不能与需要的物质反应,不能引入新的杂质;根据加入碳酸钠的目的来考虑实验顺序;根据将沉淀与滤液分离的方法考虑;(2)根据实验中过量物质的处理方法考虑.
解答 解:(1)除去镁离子是利用将镁离子沉淀出来除去,所以用氢氧根离子即可,又因为不能引入新的杂质最后得到的是氯化钠,所以阳离子是钠离子;所以X是氢氧化钠;加入碳酸钠的目的有两个:一是除去过量的氯化钡,二是除去滤液中的Ca2+;所以碳酸钠必须放在氯化钡的后面,氢氧化钠可以在前面或者在后面;①、②和③产生了三种沉淀,所以将沉淀与滤液分离的方法是通过过滤的方法;
(2)由于加入的碳酸钠和氢氧化钠都是过量的,所以加入盐酸是为的与过量的碳酸钠和氢氧化钠反应.
故答案为:(1)NaOH;过滤;
(2)HCl+NaOH═NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑.
点评 本题容易出错的地方是加入试剂的顺序的排法,关键要知道加入碳酸钠的作用,决定了碳酸钠必须放在氯化钡的后面.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
8.某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应.实验数据如下表:
请你认真分析数据,回答下列问题:
(1)哪位同学所取用的稀硫酸与铁样品恰好完全反应乙;
(2)计算样品中铁的质量分数?
(3)计算恰好完全反应后所得溶液中溶质的质量分数(计算结果精确到0.1%).
| 甲 | 乙 | 丙 | |
| 稀硫酸 | 200g | 150g | 150g |
| 加入的铁样品 | 8g | 8g | 10g |
| 产生氢气质量 | 0.2g | 0.2g | 0.2g |
(1)哪位同学所取用的稀硫酸与铁样品恰好完全反应乙;
(2)计算样品中铁的质量分数?
(3)计算恰好完全反应后所得溶液中溶质的质量分数(计算结果精确到0.1%).
12.下列关于自来水厂净水过程的说法,不正确的是( )
| A. | 加入活性炭的目的是去除异味和色素 | |
| B. | 消毒杀菌是净水过程中唯一一个化学变化 | |
| C. | 过滤后的水是纯净物 | |
| D. | 生活中可通过煮沸来降低水的硬度 |
2.下列有关化学变化的说法不正确的是( )
| A. | 化学变化中都伴随有能量变化 | |
| B. | 化学变化的特征是有新物质生成 | |
| C. | 化学变化发生时一定有物理变化发生 | |
| D. | 爆炸一定发生了化学变化 |