题目内容
在![]() 的混合液中,加入过量铁粉,充分反应后过滤,留在滤纸上的物质是
的混合液中,加入过量铁粉,充分反应后过滤,留在滤纸上的物质是
[ ]
|
A.铜 |
B.锌 |
|
C.锌和铜 |
D.铁和铜 |
答案:D

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(1)某校研究性学习小组欲配制1000g溶质质量分数为15%的氢氧化钠溶液.需氢氧化钠固体 g,水 mL(水的密度是1g/cm3);称量氢氧化钠时 (填“能”或“不能”)放在纸上称量.
(2)甲乙丙丁四位同学在探究碱溶液与酚酞作用的实验时,发现了一个意外现象:氢氧化钠溶液滴入酚酞试液,溶液变成了红色,一会儿红色就消失了.
【猜想】:
甲:可能是酚酞变质的缘故;
乙:可能是氢氧化钠溶液与空气中二氧化碳反应的缘故;
丙:可能是酚酞与空气中氧气反应,使红色消失的缘故;
丁:可能与氢氧化钠溶液质量分数大小有关.
【理论分析】:
①甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是 .
②乙同学的猜想也不正确,理由是 .
【实验设计】:
③为证实丙同学的猜想,还需作如下实验,请完成下表.
④通过以上实验,四位同学看到:溶液先变成红色,一会儿红色又消失.因此酚酞红色褪去与氧气无关.若丁同学的猜想正确,设计如下实验证明并完成有关问题:
实验方法:观察到的现象和结论;
(3)质量分数小的溶液中红色不消失,质量分数大的溶液中红色会消失,则证明
.
方案二:将滴有酚酞试液的质量分数大的氢氧化钠溶液加水稀释观察到的现象和结论: .
(4)(8分)该校研究性学习小组向上述所配制的15%的氢氧化钠溶液中滴加稀盐酸,有气泡产生,由此可知所用的NaOH固体已变质.写出氢氧化钠在空气中变质的化学方程式 ;所以氢氧化钠应该 保存.(2分)
【提出问题】:所用的NaOH变质程度怎样?
【设计方案】:先称取21.2g 的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入一定质量分数的稀硫酸直至过量,根据生成CO2的质量计算出Na2CO3的质量,从而进一步确定样品中NaOH的质量分数.
【进行实验】:实验测得加入稀硫酸的质量与产生CO2气体的质量关系如下图所示.
【数据处理】:写出以下计算过程:
(5)该样品中NaOH的质量分数为多少?
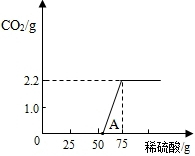
【反思与交流】:①从图中0~A点说明:在NaOH 与Na2CO3的混合溶液中,加入稀硫酸,首先反应的物质是 ;②根据反应方程式分析,NaOH部分变质或全部变质,与没有变质的NaOH相比,中和反应时消耗稀硫酸的量 (填“相等”或“大于”或“小于”.(2分)
(2)甲乙丙丁四位同学在探究碱溶液与酚酞作用的实验时,发现了一个意外现象:氢氧化钠溶液滴入酚酞试液,溶液变成了红色,一会儿红色就消失了.
【猜想】:
甲:可能是酚酞变质的缘故;
乙:可能是氢氧化钠溶液与空气中二氧化碳反应的缘故;
丙:可能是酚酞与空气中氧气反应,使红色消失的缘故;
丁:可能与氢氧化钠溶液质量分数大小有关.
【理论分析】:
①甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是
②乙同学的猜想也不正确,理由是
【实验设计】:
③为证实丙同学的猜想,还需作如下实验,请完成下表.
| 实验步骤 | 设计这一步骤的目的 |
| 1.用煮沸过的蒸馏水配制氢氧化钠溶液. | |
| 2.在氢氧化钠溶液中滴入酚酞,并在上方滴一些植物油. |
实验方法:观察到的现象和结论;
(3)质量分数小的溶液中红色不消失,质量分数大的溶液中红色会消失,则证明
方案二:将滴有酚酞试液的质量分数大的氢氧化钠溶液加水稀释观察到的现象和结论:
(4)(8分)该校研究性学习小组向上述所配制的15%的氢氧化钠溶液中滴加稀盐酸,有气泡产生,由此可知所用的NaOH固体已变质.写出氢氧化钠在空气中变质的化学方程式
【提出问题】:所用的NaOH变质程度怎样?
【设计方案】:先称取21.2g 的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入一定质量分数的稀硫酸直至过量,根据生成CO2的质量计算出Na2CO3的质量,从而进一步确定样品中NaOH的质量分数.
【进行实验】:实验测得加入稀硫酸的质量与产生CO2气体的质量关系如下图所示.
【数据处理】:写出以下计算过程:
(5)该样品中NaOH的质量分数为多少?

【反思与交流】:①从图中0~A点说明:在NaOH 与Na2CO3的混合溶液中,加入稀硫酸,首先反应的物质是
通过一年的化学学习,我们已经了解了常见金属在溶液中的活动性顺序.铬(Cr)是重要的金属材料,越来越受到人们的关注.某化学兴趣小组对Cr,Al,Cu的金属活动性顺序进行了探究,过程如下:
【提出假设】(1)对三种金属的活动性顺序提出的三种可能的假设:
a.Al>Cr>Cu b.Cr>Al>Cu c.______
【设计实验】同温下,取大小相同的打磨过的金属薄片,分别投入到体积等浓度的足量稀盐酸中,观察现象,记录如下:
【控制实验条件】(2)打磨三种金属发生的是______变化;上述实验使用等浓度的盐酸溶液的理由是______.
【得出结论】(3)原假设中正确的是______(填假设中a,b或c).写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式______.
【结论应用】(4)根据探究结果,在CuCl2和AlCl3的混合液中加入一定量的金属铬,充分反应后过滤,向滤出的固体中加入盐酸,无明显现象,则滤液中一定含有的溶质是______.
【提出假设】(1)对三种金属的活动性顺序提出的三种可能的假设:
a.Al>Cr>Cu b.Cr>Al>Cu c.______
【设计实验】同温下,取大小相同的打磨过的金属薄片,分别投入到体积等浓度的足量稀盐酸中,观察现象,记录如下:
| 金属 | Cr | Al | Cu |
| 与盐酸反应发生现象 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
【得出结论】(3)原假设中正确的是______(填假设中a,b或c).写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式______.
【结论应用】(4)根据探究结果,在CuCl2和AlCl3的混合液中加入一定量的金属铬,充分反应后过滤,向滤出的固体中加入盐酸,无明显现象,则滤液中一定含有的溶质是______.
通过一年的化学学习,我们已经了解了常见金属在溶液中的活动性顺序.铬(Cr)是重要的金属材料,越来越受到人们的关注.某化学兴趣小组对Cr,Al,Cu的金属活动性顺序进行了探究,过程如下:
【提出假设】(1)对三种金属的活动性顺序提出的三种可能的假设:
a.Al>Cr>Cu b.Cr>Al>Cu c.
【设计实验】同温下,取大小相同的打磨过的金属薄片,分别投入到体积等浓度的足量稀盐酸中,观察现象,记录如下:
|
金属 |
Cr |
Al |
Cu |
|
与盐酸反应发生现象 |
气泡产生缓慢,金属逐渐溶解 |
气泡产生激烈,金属迅速溶解 |
无气泡产生,金属无变化 |
【控制实验条件】(2)打磨三种金属发生的是 变化;上述实验使用等浓度的盐酸溶液的理由是 .
【得出结论】(3)原假设中正确的是 (填假设中a,b或c).写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式 .
【结论应用】(4)根据探究结果,在CuCl2和AlCl3的混合液中加入一定量的金属铬,充分反应后过滤,向滤出的固体中加入盐酸,无明显现象,则滤液中一定含有的溶质是 、 .
 (2013?衡阳一模)人类的生产合群生活都离不开金属.
(2013?衡阳一模)人类的生产合群生活都离不开金属.