题目内容
为了测定某铜锌合金(即铜锌混合物)中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下(实验中的误差忽略不计):

(1)试计算该铜锌合金中锌的质量分数.
(2)从上表数据分析,当所取合金与所用的稀硫酸的质量比为________时,表示合金中的锌与稀硫酸中的硫酸恰好完全反应.
解析:
|
解:(1)由“第一次”与“第二次”实验数据分析,合金均为25g,增加稀硫酸的质量时,产生氢气的质量均为0.4g,表明此时硫酸足量而合金中的锌完全反应,因此可用产生氢气的质量0.4g,求出25g合金中所含锌的质量x. Zn+H2SO4=ZnSO4+H2↑ 65 2 x 0.4g x=13g 合金中锌的质量分数为: (2)根据(1)的分析,产生0.4g氢气需25g合金.又由“第二次”和“第三次”数据比较知,当合金质量增加、硫酸质量减少时,产生的氢气质量没有变,表明第三次实验中合金过量,酸正好反应,即产生0.4g氢气所需酸的质量为100g.所以当所取合金与所用的稀硫酸的质量比为1∶4时,表示合金中的锌与稀硫酸中的硫酸恰好完全反应. |

 走进文言文系列答案
走进文言文系列答案Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
(1)不法分子常用黄铜制成金光闪闪的“假元宝”蒙骗人们.下列鉴别方法中错误的是 。
A.看颜色 B.灼烧 C.加硝酸银溶液 D.加盐酸
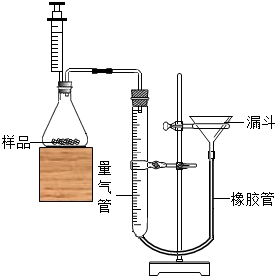
(2)为了测定某铜锌合金的组成,校化学课外活动小组利用该合金粉末与稀硫酸反应,设计了如图所示的实验装置进行实验。
①检查装置气密性的方法是:连接好装置,从漏斗注水,量气管两边形成高度差,做好标记,一段时间后,高度差 ,说明气密性良好。
②正确读取量气管内液面的初始、最终读数前都需进行的操作是 。③该小组进行了三次实验,所得相关的实验数据处理如下:
|
|
合金的质量/g |
稀硫酸的体积/mL |
生成氢气的质量/g |
|
第1次 |
2 |
15 |
0.04 |
|
第2次 |
2 |
20 |
0.04 |
|
第3次 |
4 |
15 |
0.04 |
a、列式计算2g合金中,锌的质量: 。
b、分析上表数据,第 次实验,合金中的锌与稀硫酸恰好完全反应,稀硫酸的溶质质量分数为 (结果保留到0.1%)。(实验温度下,ρ(H2SO4)=1.08g/cm3)

为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
| 第一次 | 第二次 | 第三次 | |
| 所取合金的质量/g | 10 | 10 | 20 |
| 所用稀硫酸的质量/g | 50 | 80 | 50 |
| 生成氢气的质量/g | 0.2 | 0.2 | 0.2 |
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为________时,表明合金中的锌与稀硫酸恰好完全反应.(提示:铜与稀硫酸不反应)
(3)试计算该铜锌合金中锌的质量分数.
(4)计算当所用合金与稀硫酸恰好完全反应时,所得溶液中溶质的质量分数.
 Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
(1)不法分子常用黄铜制成金光闪闪的“假元宝”蒙骗人们.下列鉴别方法中错误的是(______ )
A.看颜色 B.测密度
C.加硝酸银溶液 D.加盐酸
(2)为了测定某铜锌合金的组成,校化学课外活动小组利用该合金粉末与稀硫酸反应,设计了如右图所示的实验装置进行实验.
①检查装置气密性的方法是:连接好装置,从漏斗注水,量气管两边形成高度差,做好标记,一段时间后,高度差______,说明气密性良好.
②正确读取量气管内液面的初始、最终读数前都需进行的操作是______.
③该小组进行了三次实验,所得相关的实验数据处理如下:(实验温度下ρH2=0.09g/L)
| 合金的质量/g | 稀硫酸的体积/mL | 生成氢气的体积/mL | |
| 第一次 | 2 | 15 | 44.4 |
| 第二次 | 2 | 20 | 44.4 |
| 第三次 | 4 | 15 | 44.4 |
b、从上表数据分析,所用合金与稀硫酸的质量比为______时,合金中的锌与稀硫酸恰好完全反应.稀硫酸的溶质质量分数为______.(实验温度下,ρH2SO4=1.08g/cm3)
 (2013?浦口区一模)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
(2013?浦口区一模)Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.