题目内容
11.将11.2克铜锌合金放入烧杯,加入200克稀硫酸恰好完全反应后.烧杯内的物质总质量为211.0克.试计算:(计算结果精确到0.1)(1)原铜锌合金中铜的质量;
(2)反应后溶液中溶质的质量分数.
分析 锌与稀硫酸反应生成硫酸锌和氢气;由质量守恒定律,质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应锌和生成氯化锌的质量,进而计算出原铜锌合金中铜的质量和反应后溶液中溶质的质量分数.
解答 解:由质量守恒定律,生成氢气的质量为11.2g+200g-211.0g=0.2g.
设参加反应的锌的质量为x,生成氯化锌的质量为y,
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.2g
$\frac{65}{x}=\frac{161}{y}=\frac{2}{0.2g}$
x=6.5g y=16.1g
(1)原铜锌合金中铜的质量11.2g-6.5g=4.7g.
(2)反应后溶液中溶质的质量分数为$\frac{16.1g}{6.5g+200g-0.2g}$×100%≈7.8%.
答:(1)原铜锌合金中铜的质量4.7g;(2)反应后溶液中溶质的质量分数为7.8%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
1.“Li”不能表示( )
| A. | 单质锂 | B. | 一个锂分子 | C. | 一个锂原子 | D. | 锂元素 |
19.下列物质中,由分子构成的单质是( )
| A. | 氧气 | B. | 水 | C. | 二氧化碳 | D. | 铝 |
6.按质量计算,无论在地壳里,还是在空气中或生物细胞内,其含量都很丰富的一种元素是( )
| A. | O | B. | H | C. | Al | D. | C |
16.下列物质中,一定属于纯净物的是( )
| A. | 清新的空气 | B. | 矿泉水 | C. | 冰水共存物 | D. | 澄清的石灰水 |
20.下列各项比较中,不正确的是( )
| A. | 含碳量:生铁>钢 | B. | 标准状况下气体密度:CO2>H2 | ||
| C. | 地壳中元素的含量:Al>Fe | D. | 韧性:生铁>钢 |
1.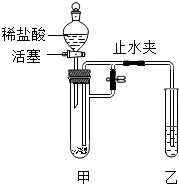 甲试管中加入固体物质,乙试管中加入某种溶液,按如图组装好仪器(其它仪器已略去).加入过量稀盐酸,关闭活塞,打开止水夹,观察到乙试管的溶液中有气泡产生,溶液始终澄清;关闭止水夹,一段时间后乙试管中溶液变浑浊.符合实验现象的一组试剂是( )
甲试管中加入固体物质,乙试管中加入某种溶液,按如图组装好仪器(其它仪器已略去).加入过量稀盐酸,关闭活塞,打开止水夹,观察到乙试管的溶液中有气泡产生,溶液始终澄清;关闭止水夹,一段时间后乙试管中溶液变浑浊.符合实验现象的一组试剂是( )
 甲试管中加入固体物质,乙试管中加入某种溶液,按如图组装好仪器(其它仪器已略去).加入过量稀盐酸,关闭活塞,打开止水夹,观察到乙试管的溶液中有气泡产生,溶液始终澄清;关闭止水夹,一段时间后乙试管中溶液变浑浊.符合实验现象的一组试剂是( )
甲试管中加入固体物质,乙试管中加入某种溶液,按如图组装好仪器(其它仪器已略去).加入过量稀盐酸,关闭活塞,打开止水夹,观察到乙试管的溶液中有气泡产生,溶液始终澄清;关闭止水夹,一段时间后乙试管中溶液变浑浊.符合实验现象的一组试剂是( )| 选项 | 甲中固体 | 乙中溶液 |
| A | NaOH | CaCl2 |
| B | Na2CO3 | KOH |
| C | CaCO3 | Ca(OH)2 |
| D | Fe | AgNO3 |
| A. | A | B. | B | C. | C | D. | D |