题目内容
【题目】元素周期表是学习和研究化学的重要工具,溴元素的相关信息如图一所示,回答下列问题:
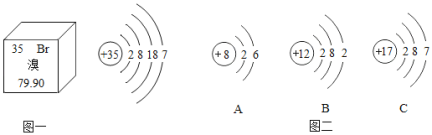
(1)溴的相对原子质量是_____;
(2)溴元素的原子在化学反应中容易_____电子(填“得到”或“失去”),其化学性质与图二中_____(填序号)元素的化学性质相似。
(3)溴元素与图二中B元素形成化合物的化学式是_____。
(4)图二中A元素的原子形成离子,其符号是_____。
【答案】79.90 得到 C MgBr2 O2﹣
【解析】
(1)溴的相对原子质量是79.90。故填:79.90。
(2)溴元素的原子最外层电子数是7,在化学反应中容易,得到电子,其化学性质与图二中氯元素的化学性质相似,这是因为溴元素和氯元素的最外层电子数都是7。故填:C。
(3)图二中B元素是镁元素,反应中容易失去2个电子形成+2价的镁元素,溴元素最外层电子数是7,反应中容易得到1个电子形成﹣1价的溴元素,由于化合物中元素化合价代数和为零,因此镁元素和溴元素形成的化合物的化学式是MgBr2。故填:MgBr2。
(4)图二中A元素是氧元素,反应中容易得到2个电子形成带2个单位负电荷的氧离子,可以表示为O2﹣。故填:O2﹣。

 名校课堂系列答案
名校课堂系列答案【题目】请从A或B两题中任选1个作答,若两题均作答,按A计分。
A | B |
火力发电厂常用石灰石浆吸收废气中的二氧化硫,以防止空气污染。反应化学方程式为: 2CaCO3+O2+2SO2===2CaSO4+2CO2若处理含有1.6 kg二氧化硫的废气,至少需要碳酸钙的质量为________ kg才能将其完全吸收。 | 原煤中含有硫,燃烧时生成的SO2会污染空气。测量SO2含量的化学方程式为:SO2+2H2O+I2=== H2SO4+2HI,取用原煤燃烧产生的工业废气样品1 m3,缓缓通过含碘(I2)1.27 mg的碘溶液,刚好完全反应。则该工业废气中SO2的含量为____mg/m3(假设工业废气中的其它物质不与碘反应)。 |
【题目】能源、水和溶液与人们的生活息息相关。
(1)目前人们利用最多的化石燃料是煤、_____和石油。
(2)车用乙醇汽油可适当节省石油资源,并在一定程度上减少汽车尾气的污染,乙醇燃烧的化学方程式为_____。
(3)检验水是硬水还是软水,可用的物质是_____,日常生活中使硬水软化的方法是_____。
(4)表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃ | 20 | 40 | 50 | 60 | 80 | |
溶解度/g | KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 |
K2CO3 | 110 | 114 | 121 | 126 | 139 | |
Ca(OH)2 | 0.17 | 0.16 | 0.14 | 0.12 | 0.09 | |
①80℃时,KNO3的溶解度_____K2CO3的溶解度(填“>”、“=”或“<”)。
②50℃时,200g饱和K2CO3溶液蒸发10g水后,再降温到50℃,可析出K2CO3晶体的质量是_____g。
③将100g 60℃的Ca(OH)2饱和溶液降温至20℃,溶液中溶质的质量_____(填“变大”、“不变”或“变小”)。
④40℃时,向两个分别盛有相同质量的KNO3和K2CO3的烧杯中,各加入100g水,充分溶解后,恢复至40℃,其结果如图所示。下列有关说法中,正确的有_____(填序号)。
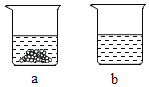
A 烧杯a中溶质是KNO3,烧杯b中溶质是K2CO3
B 烧杯b中溶液一定是不饱和溶液
C 降低温度或蒸发都有可能使烧杯b中析出固体
D 若将烧杯a中的溶液变为不饱和溶液,溶液中溶质质量分数定会减小