题目内容
为了消除碘缺乏病,我国政府规定居民的食用盐必须是加碘食盐,简称碘盐。所谓碘盐就是在食盐中加入一定量碘酸钾(KIO3)。下图为“云鹤牌”精制碘盐包装袋上的部分说明文字,请回答下列问题:
(1)碘酸钾的相对分子质量为 ,碘酸钾中钾、碘、氧元素的质量比为 ,碘酸钾中碘元素的质量分数为 。
(2)已知成人每天约需0.15mg碘,假设这些碘主要是从碘盐中摄取的。若1000g碘盐中含20mg碘,则成人每天需食用这种碘盐 g。
(3) mg碘酸钾中含20mg的碘;
(4)用单质碘(I2)与氯酸钾(KClO3 )发生反应可制得碘酸钾,同时生成氯气,该反应的化学方程式为 ,该反应属于 反应(填化学基本反应类型)。
(1)214; 39; 127; 48; 59.3%
(2)7.5g (3)33.7mg
(4)I2+2KClO3=Cl2+2KIO3;置换
解析试题分析:(1)根据相对分子的质量为组成分子的各原子的相对原子质量之和,碘酸钾相对分子质量=39+127+16×3=214;
利用各元素的质量比为各元素的相对原子质量与原子个数乘积之比,计算碘酸钾中钾元素、碘元素、氧元素的质量比=39:127:(16×3)=39:127:48;
根据物质中某元素的质量分数= ×100%,可知
×100%,可知
碘酸钾中碘元素的质量分数=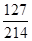 ×100%=59.3%;
×100%=59.3%;
(2)1000 g碘盐中约含20 mg碘,设x克碘盐中约含0.15mg碘,则 x×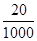 =0.15mg,解得 x=7.5g;
=0.15mg,解得 x=7.5g;
(3)含20mg碘元素的碘酸钾的质量=20mg÷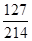 ×100%≈33.7mg;
×100%≈33.7mg;
(4)由反应物、生成物和反应条件可以写出化学方程式,碘和氯酸钾反应生成碘酸钾和氯气,故该反应的化学方程式为:I2+2KClO3=Cl2+2KIO3,该反应的反应物和生成物中各有一种单质和一种化合物,故属于置换反应。
考点:相对分子质量的概念及其计算,元素质量比的计算,元素的质量分数计算,化合物中某元素的质量计算,物质组成的综合计算,书写化学方程式及化学反应类型的判断
点评:本题主要考查学生利用信息中物质的化学式进行简单计算,学生应注重与所学知识的结合来解答,本题还注重了化学与生活的联系,可让学生认识生活中的化学知识,加强学习兴趣的引导。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 配料表 | 食用盐、碘酸钾 |
| 含碘量 | (20mg~40mg)/kg |
| 保质期 | 18个月 |
| 食用方法 | 待食物烹调好后再放入碘盐,勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
①碘酸钾中碘(I)的化合价.
②碘酸钾相对分子质量.
③碘酸钾中碘元素的质量分数.
④多少克碘酸钾中含有20 mg碘?
(2)由食用方法和贮藏方法可推测碘酸钾的化学性质之一是:
(3)若1000 g碘盐中约含20 mg碘.
①这里标明的碘的含量是指:(
A、碘单质B、碘元素C、碘原子D、碘分子
②已知成人每天约需0.15 mg碘,假设这些碘主要是从碘盐中摄取的,则成人每天需要食用碘盐多少克?
 为了消除碘缺乏病,我国政府规定居民的食用盐必须是加碘食盐,简称碘盐.所谓碘盐就是在食盐中加入一定量碘酸钾(KIO3).图为“云鹤牌”精制碘盐包装袋上的部分说明文字,请回答下列问题:
为了消除碘缺乏病,我国政府规定居民的食用盐必须是加碘食盐,简称碘盐.所谓碘盐就是在食盐中加入一定量碘酸钾(KIO3).图为“云鹤牌”精制碘盐包装袋上的部分说明文字,请回答下列问题: