题目内容
A、B、C、D分别是四种元素的一种粒子,A、B、D都已具有稳定的电子层结构.A的核电荷为19,B的质子数比A少3个,C原子的最内电子层比第二层少5个电子,D的核外只有1个电子层,且显电中性,请回答.
(1)四种粒子的符号是A:________;B:________;C:________;D:________.
(2)A和B形成的化合物化学式为________,属于________化合物.
(3)核电荷数小于20,且化学性质与D相似的元素有________(用元素符号回答).
答案:
解析:
提示:
解析:
|
(1)K+,S2-,F,He (2)K2S,离子 (3)Ne,Ar |
提示:
|
提示:此题是判断题,解判断题首先应找出突破口,比如此题中 A的核电荷数为19,则此粒子一定是钾元素的粒子;又因A已达到稳定结构,则A粒子一定是钾离子.由此突破之后,又知B的质子数比A少3个,B质子数即为16,且B也已达稳定结构,B粒子一定是硫离子.C原子最内层上的电子数比第二层少5个电子;其中最内层一定已排满了2个电子,则第二层上有5+2=7个电子,C原子核外共有2+7=9个电子,即C粒子没有达到稳定结构,说明C粒子是原子,C原子核内质子数等于核外电子数也为9,则C粒子一定是氟原子;D粒子的核外只有一个电子层,又显电中性,说明D是原子而非离子,又知D粒于也已具有稳定的电子层结构,则D粒子一定是氦原子而非氢原子或氢离子. |

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
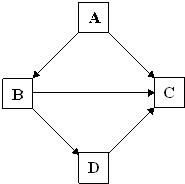 物质之间的相互转化是化学中的重要知识.某同学在复习物质性质时,绘制了框图.框图中“→”表示物质之间可以向箭头所指方向一步转化.根据框图,回答下列问题.
物质之间的相互转化是化学中的重要知识.某同学在复习物质性质时,绘制了框图.框图中“→”表示物质之间可以向箭头所指方向一步转化.根据框图,回答下列问题.
 A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现用MgSO4 溶液按右图所示的操作,可将它们
A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现用MgSO4 溶液按右图所示的操作,可将它们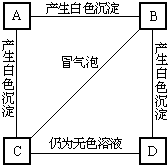 (1)A、B、C、D分别是Ba(NO3)2、Na2CO3、MgCl2和H2SO4中的各一种溶液.从表标明了它们之间两两相混的现象:根据实验事实可知:
(1)A、B、C、D分别是Ba(NO3)2、Na2CO3、MgCl2和H2SO4中的各一种溶液.从表标明了它们之间两两相混的现象:根据实验事实可知: