题目内容
29、小彬同学家新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的.他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行如下探究活动.
【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜.铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液…
铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液…
【预测】三种金属在金属活动性顺序中的相对位置关系:
①Cr Al Cu ②Al Cr Cu ③Al Cu Cr
【实验过程】取大小相同的三种金属薄片,用砂纸打磨光亮.
【请回答问题】
(1)硫酸亚铬( CrSO4)中铬元素的化合价是
(2)用砂纸打磨金属片的目的是
(3)实验一所发生反应的化学方程式是
(4)实验三结束后,试管中
(5)小东提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,小燕认为不可行,理由是
【归纳】比较金属活动性强弱的方法有①
【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜.铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液…
铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液…
【预测】三种金属在金属活动性顺序中的相对位置关系:
①Cr Al Cu ②Al Cr Cu ③Al Cu Cr
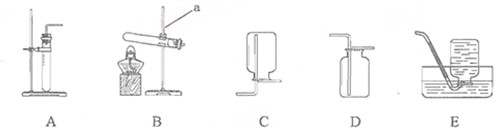
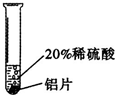
【实验过程】取大小相同的三种金属薄片,用砂纸打磨光亮.
| 实验一 | 实验二 | 实验三 | |
实验 方案 |
 |
 |
 |
| 实验 现象 |
铬片表面产生气泡缓慢,溶液变蓝色. | 无明显现象 |
铝片表面产生气泡较快. |
| 结论 | 铬能和稀硫酸发生反应,反应速率较慢. | 铜不与稀硫酸反应 | 铝能与稀硫酸发生反应,反应速率较快 |
| 三种金属在金属活动性顺序中的相对位置关系是 Al Cr Cu | |||
(1)硫酸亚铬( CrSO4)中铬元素的化合价是
+2
;(2)用砂纸打磨金属片的目的是
除去金属表面氧化物
;(3)实验一所发生反应的化学方程式是
Cr+H2SO4=CrSO4+H2↑
;(4)实验三结束后,试管中
Al3+
(填离子符号,后面同)增加了,H+
减少了;(5)小东提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,小燕认为不可行,理由是
无法比较铬和铝的金属活动性强弱
.【归纳】比较金属活动性强弱的方法有①
通过金属与酸反应判断金属活动性强
,②通过金属与盐溶液反应判断金属活动性强弱
.分析:【实验过程】根据所学金属活动顺序可知铜不能与硫酸反应,铝可以与硫酸反应,进而解决问题.
【请回答问题】(1)根据化合物中化合价代数和为零的原则解答.
(2)打磨金属表面一般是除去表面的氧化物薄膜.
(3)根据题中信息,对比锌与硫酸的反应方程式进行书写.
(4)根据铝和硫酸反应前后的离子的变化进行分析.
(5)结合实验目的进行分析.
【归纳】可结合实验的过程及课本知识进行总结.
【请回答问题】(1)根据化合物中化合价代数和为零的原则解答.
(2)打磨金属表面一般是除去表面的氧化物薄膜.
(3)根据题中信息,对比锌与硫酸的反应方程式进行书写.
(4)根据铝和硫酸反应前后的离子的变化进行分析.
(5)结合实验目的进行分析.
【归纳】可结合实验的过程及课本知识进行总结.
解答:解:【实验过程】根据我们学过的知识可知,铜与稀硫酸不反应,根据图示现象可知,铝与稀硫酸反应比较快.
故答案为:无明显现象; 铝能与稀硫酸发生反应,反应速率较快; Al Cr Cu(或“②”)
【请回答问题】(1)因为硫酸根的为-2价,根据化合价代数和为零的原则知Cr化合价为+2价.故答案为:+2
(2)因为比较活泼的金属表面有一层氧化膜,不活泼的表面有污物.故答案为:除去金属表面氧化物(或污物)
(3)由题中信息可知,铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液,结合实验一有气泡产生,应该是氢气,根据质量守恒定律配平为:Cr+H2SO4=CrSO4+H2↑
故答案为:Cr+H2SO4=CrSO4+H2↑
(4)铝与稀硫酸反应方程式为:2Al+3H2SO4=2Al2(SO4)3+3H2↑,分析可知反应后Al3+增加了,H+减少了.
故答案为:Al3+,H+;
(5)用硫酸铜溶液,只能证明A1、Cr比铜活泼,无法比较铬和铝的金属活动性强弱.
故答案为:无法比较铬和铝的金属活动性强弱(合理答案均可得分)
【归纳】①通过金属与酸反应判断金属活动性强,
②通过金属与盐溶液反应判断金属活动性强弱.
故答案为:无明显现象; 铝能与稀硫酸发生反应,反应速率较快; Al Cr Cu(或“②”)
【请回答问题】(1)因为硫酸根的为-2价,根据化合价代数和为零的原则知Cr化合价为+2价.故答案为:+2
(2)因为比较活泼的金属表面有一层氧化膜,不活泼的表面有污物.故答案为:除去金属表面氧化物(或污物)
(3)由题中信息可知,铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液,结合实验一有气泡产生,应该是氢气,根据质量守恒定律配平为:Cr+H2SO4=CrSO4+H2↑
故答案为:Cr+H2SO4=CrSO4+H2↑
(4)铝与稀硫酸反应方程式为:2Al+3H2SO4=2Al2(SO4)3+3H2↑,分析可知反应后Al3+增加了,H+减少了.
故答案为:Al3+,H+;
(5)用硫酸铜溶液,只能证明A1、Cr比铜活泼,无法比较铬和铝的金属活动性强弱.
故答案为:无法比较铬和铝的金属活动性强弱(合理答案均可得分)
【归纳】①通过金属与酸反应判断金属活动性强,
②通过金属与盐溶液反应判断金属活动性强弱.
点评:本题考查的是金属的活动性顺序的探究,是近几年来中考考查的重点内容之一.本题型考查实验设计的同时,也考查了学生对实验设计题的评价能力,希望同学们认真把握.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目