题目内容
 如图是A、B、C三种固体物质的溶解度曲线,下列叙述错误的是( )
如图是A、B、C三种固体物质的溶解度曲线,下列叙述错误的是( )| A、t1时,三物质的溶解度B的最大 |
| B、欲使t2时分置于两个容器中的A、B的饱和溶液在升温至t3时仍为饱和溶液,所需加入溶质的质量A大于B |
| C、将t3时C的饱和溶液降温到t1时,溶质的质量分数不变 |
| D、欲使组成在N点的A溶液转变为M点的A溶液,可采取加A的方法 |
考点:固体溶解度曲线及其作用,饱和溶液和不饱和溶液相互转变的方法,溶质的质量分数、溶解性和溶解度的关系
专题:溶液、浊液与溶解度
分析:根据固体的溶解度曲线可知:
①比较不同物质在同一温度下的溶解度大小;
②判断出物质的溶解度随温度变化的变化情况,从而确定通过降温还是升温的方法使饱和溶液转化成不饱和溶液;
③在溶解度曲线上及上方的点表示的都是饱和溶液,而在曲线下方的点表示的是不饱和溶液,由于可以通过蒸发溶剂的方法使不饱和溶液变成饱和溶液,从而确定是否可以使溶解度曲线下方的点转变成溶解度曲线上的点.
①比较不同物质在同一温度下的溶解度大小;
②判断出物质的溶解度随温度变化的变化情况,从而确定通过降温还是升温的方法使饱和溶液转化成不饱和溶液;
③在溶解度曲线上及上方的点表示的都是饱和溶液,而在曲线下方的点表示的是不饱和溶液,由于可以通过蒸发溶剂的方法使不饱和溶液变成饱和溶液,从而确定是否可以使溶解度曲线下方的点转变成溶解度曲线上的点.
解答:解:A、根据三种物质的溶解度曲线可知,在t1℃时,三种物质的溶解度大小关系是B>A=C,故A说法正确;
B、使t1℃时分置于两个容器中的A、B的饱和溶液在升温至t3℃时时仍为饱和溶液,虽然t3℃时A的溶解度大于B的溶解度,但由于两个容器的溶液的质量大小不确定,因此无法判断所需加入溶质的质量的多少,故B说法错误;
C、由于C的溶解度随温度的降低而增大,因此将t3时C的饱和溶液降温到t1时,溶液变为不饱和溶液,但溶质的质量分数不变,故C说法正确;
D、由于N点在溶解度曲线下方,代表的是A的不饱和溶液,当加入溶质A时,不饱和溶液就会变成饱和溶液,N点就会变成M点,故D说法正确.
故选:B.
B、使t1℃时分置于两个容器中的A、B的饱和溶液在升温至t3℃时时仍为饱和溶液,虽然t3℃时A的溶解度大于B的溶解度,但由于两个容器的溶液的质量大小不确定,因此无法判断所需加入溶质的质量的多少,故B说法错误;
C、由于C的溶解度随温度的降低而增大,因此将t3时C的饱和溶液降温到t1时,溶液变为不饱和溶液,但溶质的质量分数不变,故C说法正确;
D、由于N点在溶解度曲线下方,代表的是A的不饱和溶液,当加入溶质A时,不饱和溶液就会变成饱和溶液,N点就会变成M点,故D说法正确.
故选:B.
点评:本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,从而加深学生对固体溶解度的理解和应用.

练习册系列答案
相关题目
CeO2是一种重要的工业原料,属于( )
| A、氧化物 | B、酸 | C、单质 | D、碱 |
如图是甲、乙、丙三种物质的溶解度曲线,从图中获得的信息错误的是( )
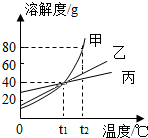

| A、t1℃时,甲、乙、丙三者的溶解度相等 |
| B、t1℃时,甲、乙、丙三者的溶液的溶质的质量分数一定相等 |
| C、分别把等质量的甲、乙两饱和溶液从t2℃降到t1℃时,两溶液析出晶体的质量甲大于乙 |
| D、t2℃时,往100g水中加入90g甲,充分搅拌后得到180g甲的溶液 |
下列有关溶液的说法正确的是( )
| A、溶液蒸干后,均能得到固体溶质 |
| B、溶液放置一段时间后,其浓度不变 |
| C、溶液中只有一种溶质时,溶液为纯净物 |
| D、物质在溶解过程中,都伴随有放热现象 |
在做空气中含氧量测定试验中,下列操作可导致空气中氧气含量大于
的是( )
| 1 |
| 5 |
| A、没有冷却至室温就打开止水夹 |
| B、红磷量不足 |
| C、红磷伸入过慢导致集气瓶口有气体逸出 |
| D、装置漏气 |

 如图是X、Y、Z三种物质的溶解度曲线.
如图是X、Y、Z三种物质的溶解度曲线.