题目内容
17.将5gCO2和CO的混合气体通过足量的灼热的氧化铜后,反应进行得很彻底,测得反应后气体的质量比反应前增加了32%,原混合气体中CO的质量分数是多少?(保留一位小数0.1克或0.1%.相对原子质量:C-12 0-16Cu-64)
分析 CO和CO2混合气体通过足量灼热的氧化铜,CO与氧化铜发生反应生成铜和二氧化碳,而使气体质量增加;因此,利用充分反应后气体增加的量,根据反应的化学方程式可计算出参加反应的CO的质量.
解答 解:反应后气体的质量比反应前增加了32%,则增加的是氧化铜氧元素的质量,故氧化铜中氧元素的质量为:5g×32%=1.6g
设混合气体中CO的质量为x
CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 气体的质量增加
28 44 44-28=16
x 1.6g
$\frac{28}{16}=\frac{x}{1.6g}$
x=2.8g
则混合气体中CO的质量分数为$\frac{2.8g}{5g}×$100%=56%
答:原混合气体中CO的质量分数是56%.
点评 根据反应前后气体物质的质量变化,利用化学方程式的气体差量进行参加反应气体的计算,可使复杂的计算得以简化.

练习册系列答案
相关题目
7.已知R2O3的式量为160,则R的相对原子质量为( )
| A. | 27 | B. | 52 | C. | 56 | D. | 120 |
8.我们平时说的补钙,其中钙是指( )
| A. | 钙元素 | B. | 钙单质 | C. | 钙原子 | D. | 钙分子 |
2.我们要增强安全和自我保护意识.下列物质与空气(或氧气)混合,遇明火不爆炸的是( )
| A. | 甲烷 | B. | 氢气 | C. | 一氧化碳 | D. | 二氧化碳 |

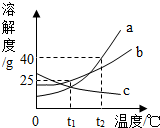 如图,a、b、c三种固体物质的溶解度变化如图所示.
如图,a、b、c三种固体物质的溶解度变化如图所示.