题目内容
某钢铁厂用含杂质20%的赤铁矿石(主要成分是Fe2O3)冶炼生铁,若日产含铁96%的生铁140吨,问要用赤铁矿石多少吨?
分析:工业冶炼生铁的原理反应为Fe2O3+3CO
2Fe+3CO2;根据反应中生成铁的质量,可计算参加反应的氧化铁的质量;
结合生铁、赤铁矿中主要成分的含量,可计算出赤铁矿的质量.
| ||
结合生铁、赤铁矿中主要成分的含量,可计算出赤铁矿的质量.
解答:解:设需要赤铁矿的质量为x
Fe2O3+3CO
2Fe+3CO2
160 112
x×(1-20% ) 140t×96%
=
x=240t
答:至少需要赤铁矿240t
Fe2O3+3CO
| ||
160 112
x×(1-20% ) 140t×96%
| 160 |
| x×(1-20% ) |
| 112 |
| 140t×96% |
x=240t
答:至少需要赤铁矿240t
点评:在使用化学方程式进行计算时,代入化学方程式的量一定是纯净物的质量,不能把混合物的质量直接代入化学方程式进行计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
人类的生产、生活离不开金属。
(1)目前年产量最高的金属是  ;
;
(2)铁在潮湿的空气里会发生锈蚀,证明氧气一定参加了反应必须要做的实验是 ;
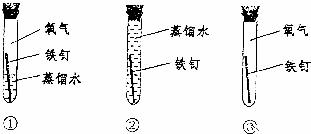
| A.①② | B.①③ | C.②③ | D.①②③ |
(3)Fe2O3中铁元素的质量分数为 ;某钢铁厂用主要成分是(Fe2O3)的赤铁矿石炼铁.钢铁厂每天需要消耗1000t含杂质20%的赤铁矿石,该厂理论上可产含Fe98%的生铁的质量是 。
(4)氧化铝难溶于水,能溶于酸或强碱溶液,它溶于氢氧化钠溶液,反应生成偏铝酸钠(NaAlO2)和水。请结合以上信息写出氧化铝与氢氧化钠溶液反应的化学方程式: 。
(5)在硫酸铜、硫酸锌和稀硫酸的混合溶液中,加入过量的铁粉(铁粉有剩余),使之充分反应后,过滤,则滤渣的成分是 ,滤液中含有的微粒是 。
