题目内容
【题目】回收金属可以减少环境污染,保护金属资源。某电路板中含有金属铁、金、铜、镍(Ni,在化合物中常显+2价)。如图是某工厂回收金属的部分流程图。

(1)步骤①中分离固液的操作是__________,溶液A中含有的阳离子有__________
(2)步骤②中生成镍的反应的化学方程式为____________________
(3)步骤④反应的化学方程式为____________________
(4)铁、金、铜、镍的金属活动性由强到弱的顺序是____________________
【答案】过滤 ![]()
![]()
![]()
![]()
【解析】
(1)步骤①中分离固液的操作是过滤;铁、镍能与稀硫酸反应,金、铜不能与稀硫酸反应,则溶液A中含有的阳离子是亚铁离子和镍离子,其离子符号为Fe2+、Ni2+。
(2)步骤②中铁与硫酸镍溶液反应生成硫酸亚铁溶液和镍,反应的化学方程式为:Fe+NiSO4═FeSO4+Ni。
(3)铜在空气中加热生成氧化铜,步骤④中氧化铜与过量稀硫酸反应生成硫酸铜和水,反应的化学方程式为:H2SO4+CuO═CuSO4+H2O。
(4)铁能与硫酸镍溶液反应,说明铁的金属活动性比镍强,则铁、金、铜、镍的金属活动性由强到弱的顺序是铁、镍、铜、金。
故答案为:
(1)过滤;Fe2+、Ni2+;
(2)Fe+NiSO4═FeSO4+Ni;
(3)H2SO4+CuO═CuSO4+H2O;
(4)铁、镍、铜、金。

 教材全解字词句篇系列答案
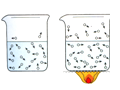
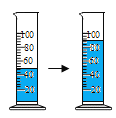
教材全解字词句篇系列答案【题目】对下列实验现象的解释错误的是
A | B | C | D | |
实验现象 |
用扫描隧道显微镜获得的分子图像 |
品红加入水中后,整个液体变红色 |
水分子在不同温度下的运动情况 |
50mL水与50mL酒精混合后的体积小于100mL |
解释 | 分子的质量和体积都很小 | 分子总是不断的运动着的 | 常温时分子不运动,加热时分子才运动 | 分子有空隙 |
A.AB.BC.CD.D
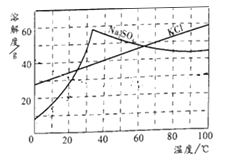
【题目】为了测定一瓶未密封保存的NaOH固体中NaOH的质量分数,小科采用沉淀法进行如下操作:①取15克样品于烧杯中,加足量水配成溶液;②在样品溶液中加入足量的BaCl2溶液;③待反应完全后,过滤。有关数据记录如下表:
反应前 | 反应后 | |
烧杯和样品溶液总质量/g | 加入的氯化钡溶液质量/g | 过滤后烧杯和溶液总质量/g (滤液的损失忽略不计) |
95 | 65 | 140.3 |
请回答下列问题:
(1)在反应前后的溶液中,下列元素质量保持不变的是___________。
A钠元素 B碳元素 C钡元素 D氧元素
(2)反应共生成沉淀________克
(3)原样品中NaOH的质量分数是________(写出计算过程)
【题目】图像与对应的表述一致的是
实验 | x轴表示的含义 | y轴表示的含义 | |
A | 将MnO2放入双氧水中 | 时间(s) | 溶液中水的质量(g) |
B | 足量红磷在装有空气的密闭的集气瓶中燃烧 | 时间(s) | 瓶内气体的体积(mL) |
C | 向白色硫酸铜粉末中逐滴滴加水 | 水的质量(g) | 溶液的质量(g) |
D | CO与CuO反应 | 通入CO的物质的量(mol) | CuO的物质的量(mol) |
A.  二氧化锰放入双氧水中
二氧化锰放入双氧水中
B.  足量红磷在装有空气的密闭集气瓶中燃烧
足量红磷在装有空气的密闭集气瓶中燃烧
C.  白色硫酸铜粉末中逐滴滴加水
白色硫酸铜粉末中逐滴滴加水
D.  CO通过灼热的CuO
CO通过灼热的CuO