题目内容
3.为探究铁、铜、锌、银四种金属的活动性顺序,同学们设计了如图所示的A、B、C三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同).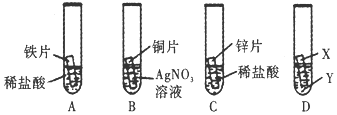
(1)实验前将金属片用砂纸打磨的目的是除去金属表面的氧化物.
(2)一段时间后,可观察到实验B中的现象是铜片表面附着一层银白色固体;发生反应的化学方程式是Cu+2AgNO3=Cu(NO3)2+2Ag.
(3)小兰同学通过实验A和C判断出锌的活动性比铁强(填“强”或“弱”),你认为她依据的实验现象是锌和稀盐酸反应产生气泡速率比铁和稀盐酸反应产生气泡速率快.
(4)小刚认为以上实验方案不足以得出四种金属的活动性顺序,他在上述实验基础上补充了实验D,实现了探究目的,若X是Fe,则Y是硫酸铜溶液,实验D中发生反应的化学方程式为Fe+CuSO4═FeSO4+Cu.
分析 锌比铁活泼,铁比铜活泼,铜比银活泼;
铜和硝酸银反应生成硝酸铜和银,铁和硫酸铜反应生成硫酸亚铁和铜.
解答 解:(1)实验前将金属片用砂纸打磨的目的是除去金属表面的氧化物.
故填:除去金属表面的氧化物.
(2)一段时间后,可观察到实验B中的现象是铜片表面附着一层银白色固体,这是因为铜和硝酸银反应生成了硝酸铜和银,发生反应的化学方程式是:Cu+2AgNO3=Cu(NO3)2+2Ag.
故填:铜片表面附着一层银白色固体;Cu+2AgNO3=Cu(NO3)2+2Ag.
(3)小兰同学通过实验A和C判断出锌的活动性比铁强,她依据的实验现象是:锌和稀盐酸反应产生气泡速率比铁和稀盐酸反应产生气泡速率快.
故填:强;锌和稀盐酸反应产生气泡速率比铁和稀盐酸反应产生气泡速率快.
(4)小刚认为以上实验方案不足以得出四种金属的活动性顺序,这是因为通过实验A和C判断出锌的活动性比铁强,通过B可以判断出铜比银活泼,但是无法比较铁和铜的活泼性,他在上述实验基础上补充了实验D,实验了探究目的,若X是Fe,则Y是硫酸铜溶液,实验D中铁和硫酸铜反应生成硫酸亚铁和铜,发生反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.
故填:硫酸铜;Fe+CuSO4═FeSO4+Cu.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列灭火方法依据的原理是隔绝氧气(或空气)的是( )
①吹灭蜡烛;
②釜底抽薪;
③柴草着火用沙土盖灭;
④汽车着火用干粉灭火器灭火;
⑤木材着火用水浇灭;
⑥油锅着火马上盖锅盖.
①吹灭蜡烛;
②釜底抽薪;
③柴草着火用沙土盖灭;
④汽车着火用干粉灭火器灭火;
⑤木材着火用水浇灭;
⑥油锅着火马上盖锅盖.
| A. | ①③④ | B. | ②④⑥ | C. | ①②⑤ | D. | ③④⑥ |
14.往一定量的稀硫酸中加入过量的铁粉,下列图象中正确的是( )
| A. |  | B. |  | C. |  | D. |  |
11.栀子花开,淡淡的清香.香满校园的原因是( )
| A. | 分子是由原子构成的 | B. | 分子的质量和体积都很小 | ||
| C. | 分子在不停的运动 | D. | 分子之间有间隔 |
18.下列常见生活物品中所含的主要材料属于有机合成材料的是( )
| A. | 橡胶轮胎 | B. | 铝制门窗 | C. | 蚕丝围巾 | D. | 玻璃水杯 |
8.稀释浓硫酸时,正确操作是( )
| A. | 将水缓缓倒入盛有浓硫酸的烧杯中,边倒边搅拌 | |
| B. | 将浓硫酸缓缓倒入盛有水的量筒中,边倒边搅拌 | |
| C. | 将浓硫酸缓缓和水一起倒入烧杯中,边倒边搅拌 | |
| D. | 将浓硫酸缓缓倒入盛有水的烧杯中,边倒边搅拌 |
12.以下科学实验中,操作正确的是( )
| A. |  | B. |  | C. |  | D. |  |
13.下面是某同学的笔记,他少记了一处.下列对该笔记“三”处的补充正确的是( )

| A. | CO2 Fe2O3 | B. | Na2CO3 NaCl | C. | KOH Ba(OH)2 | D. | HNO3 H2CO3 |



