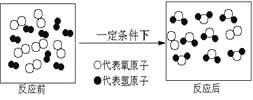
题目内容
【题目】现有100g 10%的蔗糖溶液,要使其质量分数变为20%,操作正确的是
A. 加入10g蔗糖 B. 蒸发掉原溶液质量的一半的水
C. 蒸发掉原溶剂质量的一半的水 D. 加入25%的蔗糖溶液100g
【答案】B
【解析】
要使溶液的溶质质量分数变大,常通过两种方式:①加入溶质,②蒸发溶剂,据此结合溶质质量分数的计算进行分析判断。
100g10%的蔗糖溶液含溶质的质量为100g×10%=10g,含溶剂100g-10g=90g;A、设需要再溶解该物质的质量为x,(100g+x)×20%=100g×10%+x,x=12.5g,故选项采用的方法错误;B、设需要蒸发水的质量为y,(100g-y)×20%=100g×10%,y=50g,应将溶剂蒸发掉溶液质量的一半,故选项采用的方法正确;C、设需要蒸发水的质量为y,(100g-y)×20%=100g×10%,y=50g,应将溶剂蒸发掉溶液质量的一半,不是蒸发掉原溶剂质量的一半的水,故选项采用的方法错误;D、加入25%的蔗糖溶液100g后,所得溶液的溶质质量分数=![]() ×100%=17.5%,故选项采用的方法错误。故选B。
×100%=17.5%,故选项采用的方法错误。故选B。

【题目】小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。
(完成实验)按下表进行实验:测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度 |
① | KClO3 | 580℃ |
② | KClO3、MnO2(质量比1:1) | 350℃ |
③ | KClO3、CuO(质量比l:1) | 370℃ |
④ | KClO3、Fe2O3(质量比1:1) | 390℃ |
(分析数据、得出结论)
(1)由实验__________与实验④对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是____________。
(3)若Fe2O3是该反应的催化剂,请写出这个反应的文字表达式___________。
(4)如表是二氧化锰用量与一定质量氯酸钾制取氧气反应速率关系的实验数据。
二氧化锰与氯酸钾的质量比 | 1:40 | 1:20 | 1:10 | 1:5 | 1:3 | 1:2 |
生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 |
①据如表可知二氧化锰与氯酸钾的质量比为_______________时,反应速率最快
②通过分析可知,在化学反应中催化剂的用量____________越多越好 (填“是”或“不是”);
③二氧化锰用量过多冲淡了氯酸钾粉末,相当于减少反应物的________,所以反应速率受到影响。