题目内容
1.海洋是人类巨大的资源宝库,海水中含有的化学元素有80多种.(1)海底蕴藏着大量可燃烧的“冰”,其主要成分是天然气水合物.
(2)从海水中提取镁的流程如下:
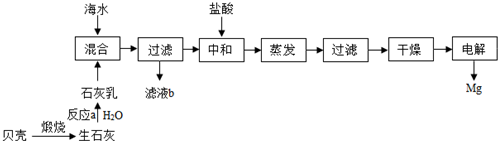
①在金属活动性顺序表中镁位于钠和铝之间.
②流程中未涉及到的基本反应类型是C(填番号).
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
③中和过程的化学反应方程式为Mg(OH)2+2HCl═MgCl2+2H2O.
分析 (1)根据天然气水合物的定义和主要成份进行分析判断.
(2)根据金属活动性顺序来分析;根据海水提取镁的过程,结合反应物和生成物确定反应类型.根据方程式的书写方法:一写二配三注明四等号进行正确书写.
解答 解:(1):“可燃冰”是水和甲烷在低温、高压的条件下形成的冰状固体.分布于深海沉积物中,由天然气与水在高压低温条件下形成的类冰状的结晶物质.故填:天然气水合物;
(2)①根据金属的活动性顺序可知,镁介于钠与铝之间;故填:钠和铝:
②水与生石灰反应生成氢氧化钙是化合反应,氢氧化镁与盐酸反应生成氯化镁和水是复分解反应,氯化镁通电分解成镁和氯气是分解反应.
故选:C.
③反应物是氢氧化镁和盐酸,生成物是氯化镁和水,用观察法配平即可,所以方程式是:Mg(OH)2+2HCl═MgCl2+2H2O;故填:Mg(OH)2+2HCl═MgCl2+2H2O.
点评 解答本题关键是要知道方程式的书写注意事项并能灵活运用.

练习册系列答案
相关题目
11.化学中存在有很多的“相等”.下列说法中不正确的是( )
| A. | 反应前物质的总质量等于反应后物质的总质量 | |
| B. | 化合物中元素化合价的正价代数和与负价的代数和相等 | |
| C. | 化学反应前后各种原子的个数相等 | |
| D. | 同种元素的原子和离子的电子数相等 |
12.下列物质中,属于纯净物的是( )
| A. | 矿泉水 | B. | 五氧化二磷 | C. | 苹果醋 | D. | 纯牛奶 |
9.下列物质属于纯净物的是( )
| A. | 空气 | B. | 盐酸 | C. | 胆矾 | D. | 过磷酸钙 |
16.下列实验操作不能达到目的是( )
| A. | 海水淡化:蒸馏 | |
| B. | 除去粗盐中的不溶物:溶解、过滤、蒸发 | |
| C. | 鉴别H2和CO:点燃,观察火焰 | |
| D. | 除去Cu粉中的Fe:加入稀盐酸,过滤 |
13.(1)在下表的空白处填上恰当的内容:
(2)小丽同学做完镁条在空气中燃烧的实验之后,对该变化的实质进行研究,氧原子和镁原子的结构示意图如图1所示,从氧原子和镁原子的结构示意图可以看出,氧原子和镁原子结合时,氧原子易得到2个电子,镁原子易失去2个电子,形成的两种粒子的符号分别是O2-、Mg2+.
②镁条在空气中燃烧的化学方程式为2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO.
(3)如图2是两种物质发生中和反应的微观示意图,请回答下列问题:
①图中发生中和反应的化学方程式为:HCl+NaOH=NaCl+H2O.
②当恰好完全中和后,反应的实质可以用一个式子表示为H++OH-=H2O,此时溶液中存在的离子是Na+、Cl-(填符号).

| 物质名称 | 物质的组成(用化学式表示) | 构成物质的微粒(用符号表示) |
| 干冰 | ||
| 锌 | ||
| 食盐水 | ---------- |
②镁条在空气中燃烧的化学方程式为2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO.
(3)如图2是两种物质发生中和反应的微观示意图,请回答下列问题:
①图中发生中和反应的化学方程式为:HCl+NaOH=NaCl+H2O.
②当恰好完全中和后,反应的实质可以用一个式子表示为H++OH-=H2O,此时溶液中存在的离子是Na+、Cl-(填符号).

11. 要使如图装置中的小气球鼓起来,则使用的固体和液体可以是( )
要使如图装置中的小气球鼓起来,则使用的固体和液体可以是( )
①锌和稀硫酸 ②石灰石和盐酸 ③生石灰和水 ④铁锈和盐酸 ⑤二氧化锰和双氧水 ⑥氢氧化钙和水.
 要使如图装置中的小气球鼓起来,则使用的固体和液体可以是( )
要使如图装置中的小气球鼓起来,则使用的固体和液体可以是( )①锌和稀硫酸 ②石灰石和盐酸 ③生石灰和水 ④铁锈和盐酸 ⑤二氧化锰和双氧水 ⑥氢氧化钙和水.
| A. | ①②③⑤ | B. | ①②④⑤ | C. | ①②④⑤⑥ | D. | ①②③④⑤⑥ |

