题目内容
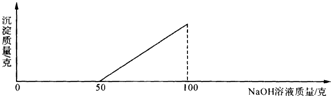
在硫酸与硫酸铜的混合溶液200g中,滴入40%的氢氧化钠溶液100g,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.问:(1)与硫酸铜反应的氢氧化钠溶液的质量为______g.
(2)将容器中的溶液在t℃时恒温蒸发27克水后,恰好达到饱和,计算t℃时饱和溶液的溶质质量分数为多少?

【答案】分析:(1)通过图象分析可知,开始阶段是硫酸与氢氧化钠的反应,从氢氧化钠溶液50g起开始与硫酸铜反应,直到100g结束.
(2)通过分析知道氢氧化钠的钠完全转化成了硫酸钠,通过化学式可计算硫酸钠的质量,再通过利用反应前物质的总质量减去计算得到的氢氧化铜的质量求溶液的总质量,进而进行求解.
解答:解:(1)通过图象分析可知,开始阶段是硫酸与氢氧化钠的反应,从氢氧化钠溶液50g起开始与硫酸铜反应,直到100g结束,则反应时与硫酸铜反应的氢氧化钠溶液的质量为50g,故答案为:50g.
(2)由分析知氢氧化钠中的钠完全转化成了硫酸钠,通过分析知道氢氧化钠的钠完全转化成了硫酸钠,通过化学式可计算硫酸钠的质量,再通过利用反应前物质的总质量减去计算得到的氢氧化铜的质量求溶液的总质量,进而进行求解.
氢氧化钠与硫酸和硫酸铜生成的硫酸钠的质量为:[100g×40%× ]÷
]÷ =71g
=71g
设生成的氢氧化铜的质量是x
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
80 98
50g×40% X
 =
=
x=24.5g
则饱和溶液的质量为:200g+100g-24.5g-27g=248.5g
饱和溶液的溶质质量分数为 ×100%=28.6%
×100%=28.6%
答:饱和溶液的溶质质量分数为28.6%
点评:此题是有关化学方程式及溶液的有关计算,涉及到已知反应物求生成物,溶液溶质质量分数的计算,解决此题对培养学生分析问题的能力有较好的帮助.
(2)通过分析知道氢氧化钠的钠完全转化成了硫酸钠,通过化学式可计算硫酸钠的质量,再通过利用反应前物质的总质量减去计算得到的氢氧化铜的质量求溶液的总质量,进而进行求解.
解答:解:(1)通过图象分析可知,开始阶段是硫酸与氢氧化钠的反应,从氢氧化钠溶液50g起开始与硫酸铜反应,直到100g结束,则反应时与硫酸铜反应的氢氧化钠溶液的质量为50g,故答案为:50g.
(2)由分析知氢氧化钠中的钠完全转化成了硫酸钠,通过分析知道氢氧化钠的钠完全转化成了硫酸钠,通过化学式可计算硫酸钠的质量,再通过利用反应前物质的总质量减去计算得到的氢氧化铜的质量求溶液的总质量,进而进行求解.
氢氧化钠与硫酸和硫酸铜生成的硫酸钠的质量为:[100g×40%×
 ]÷
]÷ =71g
=71g设生成的氢氧化铜的质量是x
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
80 98
50g×40% X
 =
=
x=24.5g
则饱和溶液的质量为:200g+100g-24.5g-27g=248.5g
饱和溶液的溶质质量分数为
 ×100%=28.6%
×100%=28.6%答:饱和溶液的溶质质量分数为28.6%
点评:此题是有关化学方程式及溶液的有关计算,涉及到已知反应物求生成物,溶液溶质质量分数的计算,解决此题对培养学生分析问题的能力有较好的帮助.

练习册系列答案
相关题目
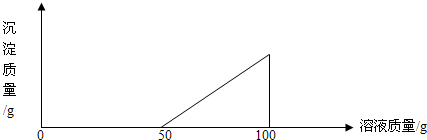
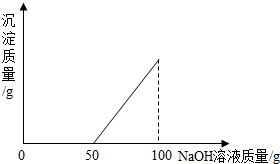 在硫酸与硫酸铜的混合溶液200g中,滴入40%的氢氧化钠溶液100g,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.问:
在硫酸与硫酸铜的混合溶液200g中,滴入40%的氢氧化钠溶液100g,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.问: