题目内容
11.我国约在南北朝时就开始冶铸黄铜,黄铜是铜和锌的合金,它用来制造机器、电器零件及日用品.为了测定某黄铜样品中铜的质量分数,取32.5g该黄铜样品加入到200g稀硫酸中,恰好完全反应,产生氢气0.4g.试求:(1)该黄铜样品中铜的质量分数;
(2)原稀硫酸溶液中溶质的质量分数.
分析 锌和稀硫酸反应生成硫酸锌和氢气,根据氢气的质量可以计算锌的质量和硫酸中硫酸的质量,进一步可以计算该黄铜样品中铜的质量分数和原稀硫酸溶液中溶质的质量分数.
解答 解:(1)设锌的质量为x,硫酸的质量为y,
Zn+H2SO4═ZnSO4+H2↑,
65 98 2
x y 0.4g
$\frac{65}{x}$=$\frac{98}{y}$=$\frac{2}{0.4g}$,
x=13g,y=19.6g,
该黄铜样品中铜的质量分数为:$\frac{32.5g-13g}{32.5g}$×100%=60%,
答:该黄铜样品中铜的质量分数为60%.
(2)原稀硫酸溶液中溶质的质量分数为:$\frac{19.6g}{200g}$×100%=9.8%,
答:原稀硫酸溶液中溶质的质量分数为9.8%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
6.下列变化不能通过一步反应实现的是( )
| A. | Cu→Cu (OH)2 | B. | Zn→Ag | C. | CaCl2→Ca CO3 | D. | Na2CO3→CaCO3 |
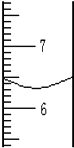 用量筒量取一定体积液体时,液面如图所示,该液体的体积是6.3mL.所用到的仪器的有量筒和胶头滴管.读取量筒内液体体积时视线应跟凹液面的最低处保持相平.若仰视,读数会<实际值;(填“<、>或=”)若俯视,读数会>实际值;(填“<、>或=”)
用量筒量取一定体积液体时,液面如图所示,该液体的体积是6.3mL.所用到的仪器的有量筒和胶头滴管.读取量筒内液体体积时视线应跟凹液面的最低处保持相平.若仰视,读数会<实际值;(填“<、>或=”)若俯视,读数会>实际值;(填“<、>或=”) 菠菜柔软滑嫩、味美色鲜,但菠菜中草酸含量较高,如果食用含草酸较多的食物,尿中草酸含量明显增多,尿路结石的危险性也随之增加.小科通过查资料得知,草酸的化学式为H2C2O4并且草酸受热会分解,他对草酸受热分解及其产物的检验做了探究
菠菜柔软滑嫩、味美色鲜,但菠菜中草酸含量较高,如果食用含草酸较多的食物,尿中草酸含量明显增多,尿路结石的危险性也随之增加.小科通过查资料得知,草酸的化学式为H2C2O4并且草酸受热会分解,他对草酸受热分解及其产物的检验做了探究