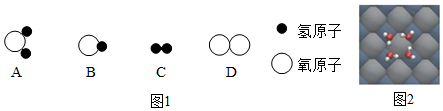
题目内容
14.某化学兴趣小组三位同学在学习了稀盐酸与氢氧化钠反应后,结合自己所做的实验,分别从不同方面对其进行图象描述.A是实际操作图,B是反应过程中溶液的酸碱度变化图,C是微观粒子结合过程的示意图.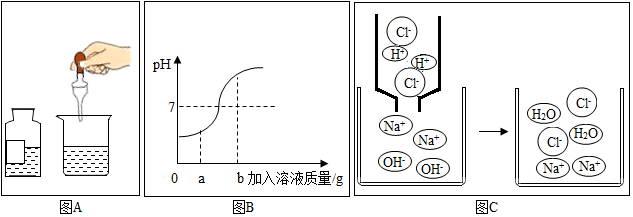
(1)该变化对应的实验操作是将稀盐酸滴加到另一种溶液中;
(2)当滴入溶液质量为ag时,溶液中的溶质为NaCl、NaOH(填化学式);
(3)当溶液的PH=7时,溶液中的主要离子是Na+、Cl-(填离子符号);
(4)当加入溶液质量为bg时,向所得溶液中滴加紫色石蕊试液,溶液呈红色;
(5)从反应前后离子的种类看,有些离子参与了反应,有些离子只是旁观者.该反应中参与反应的离子是H+、OH-.
(6)实验中使用的氢氧化钠溶液质量是40g,质质量分数是10%.反应后所得溶液PH为7时,消耗稀盐酸的质量是40g,则所用稀盐酸的溶质质量分数是多少?
分析 (1)根据坐标变化的趋势结合盐酸的pH小于7,氢氧化钠溶液的pH大于7分析;
(2)当加入溶液的质量为ag时,溶液呈现碱性,溶液中既有生成的氯化钠,又有未反应的氢氧化钠;
(3)根据当溶液的pH=7时,酸碱恰好完全反应解答;
(4)当加入溶液的质量为bg时,溶液显碱性;
(5)根据中和反应的实质是酸电离的氢离子和碱电离的氢氧根离子相互作用生成水的过程,即中和反应的实质是H++OH-=H2O.
(6)根据氢氧化钠溶液的质量和溶质质量分数、稀盐酸的质量,根据化学方程式可以计算出稀盐酸的溶质质量分数解答.
解答 解:(1)坐标的pH变化是由大于7到小于7的过渡,因此进行的操作是将稀盐酸滴加到氢氧化钠溶液中.故填:稀盐酸;
(2)当加入溶液的质量为ag时,溶液呈现碱性,所得溶液中的溶质为氢氧化钠和氯化钠,故填:NaCl、NaOH;
(3)当溶液的pH=7时,酸碱恰好完全反应,溶液中的主要离子是钠离子和氯离子;故填:Na+、Cl-;
(4)当加入溶液的质量为bg时,所得溶液显酸性,所得溶液中的溶质为氯化氢和氯化钠,向所得溶液中滴加紫色石蕊试液,溶液呈红色;故填:红;
(5)中和反应的实质是酸电离的氢离子和碱电离的氢氧根离子相互作用生成水的过程,即中和反应的实质是H++OH-=H2O;故填:H+、OH-.
(6)设HCl的质量为x,氢氧化钠的质量为40g×10%=4g
NaOH+HCl=NaCl+H2O
40 36.5
4g x
$\frac{40}{4g}=\frac{36.5}{x}$
x=3.65g
实验中所用稀盐酸中溶质的质量分数是$\frac{3.65g}{40g}×$100%=9.125%
答案:实验中所用稀盐酸中溶质的质量分数是9.125%
点评 解答本题的关键是根据坐标的pH变化结合溶液的酸碱性与溶液pH的关系进行分析,并对反应过程中的溶液的酸碱性正确判断.

| A. | 27.6% | B. | 41.2% | C. | 53.8% | D. | 58.3% |
| A. | 苛性钠Na2CO3 | B. | 干冰H2O | C. | 生石灰Ca(OH)2 | D. | 水银Hg |
| A. |  | B. |  | C. |  | D. |  |
| 选项 | 用途 | 化学原理(用化学方程式表示) |
| A | 镁粉用于制照明弹 | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO |
| B | 稀硫酸用于除铁锈 | Fe+H2SO4═FeSO4+H2↑ |
| C | 氢氧化铝用于治疗胃酸过多 | Al(OH)3+3HCl═AlCl3+3H2O |
| D | 天然气用作燃料 | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O |
| A. | A | B. | B | C. | C | D. | D |