题目内容
(相对原子质量:H:1,O:16,Mg:24,Zn:65)
实验室用13g锌跟足量的稀硫酸反应,可制得氢气多少克?在标准状况下该气体为多少升?(标准状况下氢气密度为0.09g/L) (反应方程式:Zn+H2SO4═ZnSO4+H2↑)
实验室用13g锌跟足量的稀硫酸反应,可制得氢气多少克?在标准状况下该气体为多少升?(标准状况下氢气密度为0.09g/L) (反应方程式:Zn+H2SO4═ZnSO4+H2↑)
分析:欲正确解答本题,需根据化学方程式得出各物质之间的质量比,列出比例式,通过计算得出生成氢气的质量.而后根据体积=
质量计算其体积即可.
| 质量 |
| 密度 |
解答:解:设生成氢气的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 2
13g x
=
解之得:x=0.4g.
这些气体的体积是
≈4.44L.
答:生成氢气的质量为0.4克,这些氢气在标准状况下的体积是4.44升.
Zn+H2SO4═ZnSO4+H2↑
65 2
13g x
| 65 |
| 2 |
| 13 |
| x |
解之得:x=0.4g.
这些气体的体积是
| 0.4g |
| 0.09g/L |
答:生成氢气的质量为0.4克,这些氢气在标准状况下的体积是4.44升.
点评:本题主要考查学生运用化学方程式和物质的密度公式进行计算的能力,难度不大,属基础性知识考查题;

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
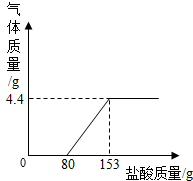 某造纸厂排放的废水中含有Na2CO3和NaOH.为了测定废水中Na2CO3的质量分数,取废水100g,逐滴滴加稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示.
某造纸厂排放的废水中含有Na2CO3和NaOH.为了测定废水中Na2CO3的质量分数,取废水100g,逐滴滴加稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示.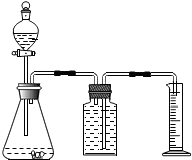 利用如图装置能制取氧气并测定所收集气体的体积.
利用如图装置能制取氧气并测定所收集气体的体积.