题目内容
小华测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀盐酸和必要的仪器。
(1)你认为能测出其铜的质量分数的是 合金。
(2)小华取该合金的粉末65g与足量该盐酸充分反应,经测定,产生了0.4g气体,请求出该合金中铜的质量分数。
(3)若想测出该盐酸的质量分数,实验时必须提供和测出的数据是 (填序号)。
A.参加反应的合金质量;B.参加反应的稀盐酸的质量;C.产生气体的质量
(1)Cu-Zn合金(或铜-锌合金)
(2)设合金中含铜的质量为x
Zn + 2HCl = ZnCl2 + H2↑
65 2
65-x 0.4g
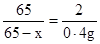
x=52g (1分)
合金中铜的质量分数为: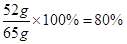
答:混合物中含铜的质量分数为80%。
(3)BC
【解析】试题分析:在金属活动性顺序中,氢前的金属能与酸发生置换反应生成氢气,根据生成氢气的质量,可以求得合金中锌的质量,从而求得铜的质量和铜的含量,要求盐酸的溶质的质量分数,需知道盐酸中溶质的质量和所用盐酸溶液的质量。
解:(1)只给出盐酸和必要的仪器,则合金中需含有能与盐酸反应的金属,锌排在氢的前面,而铜和银排在氢的后面,故能测出铜锌合金中铜的质量分数;
(2)设生成0.4g氢气需要锌的质量为x,则有
Zn+2HCl═ZnCl2+H2↑
65 2
x 0.4g
65:2=x:0.4g
解得x=13g
该合金中的Cu的质量分数是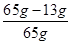 ×100%=80%
×100%=80%
(3)要求盐酸的溶质的质量分数,需知道溶质的质量和溶液的质量,知道所用的盐酸的体积和盐酸的密度,能求出盐酸的质量,而溶质的质量可以通过氢气的质量求出。
考点:本题考查金属活动性顺序及其应用,酸的化学性质
点评:根据化学方程式进行的计算时,要注意解题的规范性。完成此题,可以依据金属活动性顺序及其意义进行解答。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案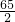 =
=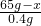
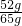 ×100%=80%
×100%=80% =
=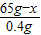
 ×100%=80%
×100%=80%