题目内容
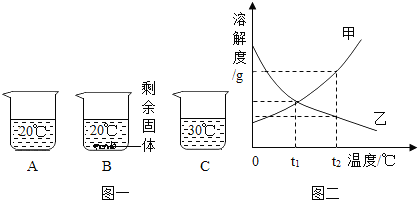
向装有等量水的A、B、C烧杯中分别加入5g、6g、6g某固体X,充分溶解后,现象如下图所示。
(1)烧杯中的溶液一定属于饱和溶液的是 (填序号)。
(2)图二能表示固体X溶解度曲线的是 (填“甲”、“乙”或“丙”)。
(3)甲溶液中混有少量丙,采用 方法可以得到比较纯的甲。
(4)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的 (填序号)

①所含溶剂质量:甲<乙
②甲、乙都是饱和溶液
③溶液质量:甲>乙
④溶质质量分数:甲>乙.
(1)B (2)乙 (3)冷却结晶(或冷却热饱和溶液结晶) (4)①④
【解析】
试题分析:(1)由图一可知,30℃时,向A烧杯中加入5gX固体完全溶解,则可能是饱和溶液,也可能不是;而向B烧杯中加入6gX固体时,有剩余固体未溶解,则一定是饱和溶液;20℃时,向C烧杯中加入6gX固体完全溶解,则可能是饱和溶液,也可能不是。故选B
(2)根据图一中的B、C可知,在等质量的水中,随着温度的降低,溶解的X的质量会逐渐增加,即说明X固体的溶解度随温度的降低而增大,所以在图二中,能表示X的溶解度曲线的是乙。
(3)根据图二的溶解度曲线可知,甲、丙两物质的溶解度都随温度的升高而增大,且甲物质的溶解度受温度的影响较大,而丙物质的溶解度受温度影响较小,故要提纯混有少量丙物质的甲物质,可用降温结晶的方法提纯甲。
(4)根据溶解度曲线分析。
①由溶解度曲线可知,t2℃时甲的溶解度大于乙的溶解度,所以此时,各100g的饱和溶液中所含溶剂的质量是甲<乙,而降低温度的过程中溶剂的质量不变,故将100g甲、乙的饱和溶液从t2℃降温到t1℃时,溶剂的质量关系依然是甲<乙,正确;
②由溶解度曲线可知,乙物质的溶解度随温度的降低而逐渐增大,故降低温度会使乙的饱和溶液变为不饱和溶液,错误;
③由溶解度曲线可知,甲物质的溶解度随温度的降低而减小,乙物质的溶解度随温度的降低而逐渐增大,故分别将100g甲、乙的饱和溶液从t2℃降温到t1℃时,甲有溶质析出(溶液质量减小),而乙变为不饱和溶液,则甲溶液的质量<乙,错误;
④根据上面的分析可知,降温后乙的溶质质量分数不变(仍等于t2℃时的饱和溶液的溶质质量分数),而甲在t1℃时仍为饱和溶液,根据饱和溶液的溶质质量分数= ×100﹪,再结合溶解度曲线图可知,t1℃时甲的溶解度大于t2℃时乙的溶解度,故甲的溶质质量分数>乙,正确。故选①④
×100﹪,再结合溶解度曲线图可知,t1℃时甲的溶解度大于t2℃时乙的溶解度,故甲的溶质质量分数>乙,正确。故选①④
考点:饱和溶液和不饱和溶液,结晶的原理、方法及其应用,固体溶解度曲线及其作用
点评:本题主要考查了固体溶解度曲线所表示的意义,及根据固体溶解度曲线来解决相关问题,注重培养学生的分析问题、解决问题的能力,解题的关键是要熟记和理解固体溶解度曲线及其应用,以及溶质质量分数的有关计算。

 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案