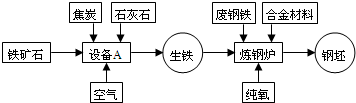
题目内容
| 物质跟氧发生的反应属于氧化反应,发生氧化反应的物质在反应中作还原剂.物质中的元素的化合价升高则被氧化,被氧化的物质作还原剂. | |
| 解答: | 解:在2Mg+CO2 故选A. |
| (1)物质的性质决定物质的用途,根据常见化学物质的性质和用途进行分析解答即可. | |
| 解答: | 解:(1)①氢气燃烧生成水,能够做清洁燃料; ②氢氧化钙能用于改良酸性土壤; ③硝酸钾中含有钾元素和氮元素,可用作复合肥料; ④活性炭具有吸附性,可用作冰箱除味剂. 故答案为:(1)①H2;②Ca(OH)2;③KNO3;④C; (2)乳酸(C3H6O3)由碳、氢、氧三种元素组成;物质中某元素的质量分数= 摩尔质量是指单位物质的量的物质所具有的质量,乳酸的相对分子质量是12×3+16×3+1×6=90,故乳酸(C3H6O3)的摩尔质量是90g/mol;1mol任何物质中含有6.02×1023个分子,一个乳酸分子含有3个氧原子,故1mol乳酸中有1mol×3×6.02×1023个=1.806×1024个碳原子. 故答案为:三;氧;90g/mol;1.806×1024. |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2MgO+C中,镁得到氧,发生了氧化反应,在反应中作还原剂.
2MgO+C中,镁得到氧,发生了氧化反应,在反应中作还原剂. ×100%,乳酸(C3H6O3)中碳原子相对原子质量的总和是12×3=36,氧原子相对原子质量的总和是16×3=48,氢原子相对原子质量的总和是1×6=6,由于乳酸(C3H6O3)的相对分子质量一定,所以乳酸(C3H6O3)中氧的质量分数最大;
×100%,乳酸(C3H6O3)中碳原子相对原子质量的总和是12×3=36,氧原子相对原子质量的总和是16×3=48,氢原子相对原子质量的总和是1×6=6,由于乳酸(C3H6O3)的相对分子质量一定,所以乳酸(C3H6O3)中氧的质量分数最大;