题目内容
 (1)某同学按如图装置对质量守恒定律进行实验探究,观察到反应后天平不平衡,该反应
(1)某同学按如图装置对质量守恒定律进行实验探究,观察到反应后天平不平衡,该反应(2)由质量守恒定律可知,化学反应前后,一定不变的是
①原子种类;②原子数目;③分子种类;④分子数目;⑤元素种类;⑥物质种类
(3)硝酸在工业生产中且有广泛的应用.工业上制取硝酸的关键反应为:
4NH3+5O2
| ||
| △ |
分析:由该题实验现象得不出正确结论,因为此实验生成二氧化碳,而实验装置是敞口的,故反应后称得质量减小,但任何化学反应均遵循质量守恒定律,不可由错误实验得出错误结论.从微观上讲,化学反应的过程就是分子分成原子,原子重新组合成新分子的过程,在此过程中,原子的种类、数目、质量均未发生变化,所以反应前后各物质的质量总和必然相等.还可以说化学变化的过程是破坏旧分子生成新分子的过程,所以,反应前后分子种类一定改变,分子数目可增可减,也可能前后相等.元素是具有相同核电荷数的一类原子的总称,所以,元素的种类与质量在反应前后也不发生改变.运用各个知识点可对应解决不同题目.
解答:解:(1)一切化学反应均遵循质量守恒定律,该题中,参加反应的碳酸钠与盐酸的质量总和等于生成的氯化钠、水和二氧化碳的质量总和,天平的不平衡是因为反应后的二氧化碳散逸到了空气中,不能说不遵循质量守恒定律.从微观上看,化学反应的过程就是原子重新组合的过程,在反应前后,原子的种类、数目、质量均不改变,反映到宏观物质上,物质质量总和必然前后相等.
(2)从质量守恒定律的定义可以得出,化学反应前后,一定不变的是物质的质量总和;由化学反应的微观解释可以得出,化学反应前后,一定不变的有:原子的种类、数目和质量;由元素的定义可知,化学反应前后,一定不变的有:元素的种类和质量;另外,化学反应前后,分子种类一定改变,分子数目可能改变,物质种类一定改变.
(3)依据化学反应前后原子的种类、数目不发生改变:N原子前后均为4,故R中无N原子;反应前有12个H原子,而NO中无H原子,故“6R”中有12个H原子,每个R中有2个H原子;同理可得每个R中含1个O原子,即化学式为:H2O
故答案为:(1)符合;反应前后原子种类、数目、质量都不变
(2)①②⑤
(3)H2O
(2)从质量守恒定律的定义可以得出,化学反应前后,一定不变的是物质的质量总和;由化学反应的微观解释可以得出,化学反应前后,一定不变的有:原子的种类、数目和质量;由元素的定义可知,化学反应前后,一定不变的有:元素的种类和质量;另外,化学反应前后,分子种类一定改变,分子数目可能改变,物质种类一定改变.
(3)依据化学反应前后原子的种类、数目不发生改变:N原子前后均为4,故R中无N原子;反应前有12个H原子,而NO中无H原子,故“6R”中有12个H原子,每个R中有2个H原子;同理可得每个R中含1个O原子,即化学式为:H2O
故答案为:(1)符合;反应前后原子种类、数目、质量都不变
(2)①②⑤
(3)H2O
点评:该题考查的是质量守恒定律的运用,解决此类题目,首先理解质量守恒定律的概念,把握“参加”、“质量总和”的含义,明确质量守恒定律的微观解释,熟记化学反应前后的五个不变(物质总质量、原子种类、数目、质量、元素种类、质量),两个一定变(物质种类、分子种类),一个可能变(分子数目),然后才能针对不同题目考查的不同侧重点运用相应知识点对症下药.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案
相关题目
某化学研究性学习小组参加社会社会实践调查得知:某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了以下制备(NH4)2SO4的工艺流程.
[工艺流程示意图]
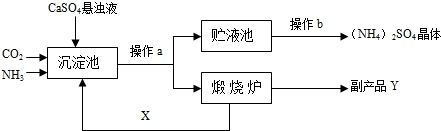
上述流程中,沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
[讨论交流]
(1)操作a的名称是 ,实验室中进行此操作时,用到的玻璃仪器除玻璃棒、烧杯外,还需要 .
(2)经操作a后得到的某物质在煅烧炉中发生反应的化学方程式为 .该工艺中,X在沉淀池中被消耗,在煅烧炉中又生成,故X可循环使用.X的填化学式为 .
(3)图中操作b应怎样进行呢?
查阅资料:右图是硫酸铵在水中的溶解度曲线.
表:固体硫酸铵在部分温度时的溶解度.
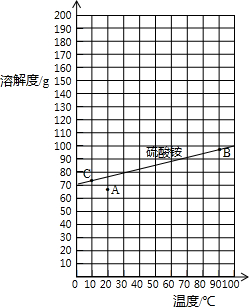
下列说法正确的有 .
①从溶解度曲线中,可以查找70℃时硫酸铵的溶解度约90g;②图中的A点表示硫酸铵溶液的状态不饱和;③若将A点变成B点的操作采用加热蒸发、使溶液浓缩的方法④若将B点转化为C点时,采用的是冷却热饱和溶液方法
该化肥厂生产的硫酸铵化肥品质怎样呢?
[查阅资料]下表是硫酸铵化肥品质的主要指标.
氨气极易溶于水,其水溶液为氨水,呈碱性.
已知:(NH4)2SO4+2NaOH
Na2SO4+2NH3↑+2H2O
[观察外观]该硫酸铵化肥无可见机械杂质.
[实验探究]按如图所示装置进行实验.
(1)实验过程中,为使硫酸铵充分反应完全转化为NH3,则需往烧瓶中加入足量浓氢氧化钠溶液并充分加热.
(2)选择右图装置A进行实验的原因 ,烧杯中盛放的试剂稀硫酸可以吸收氨气,两者化合生成一种盐,写出化学方程式 .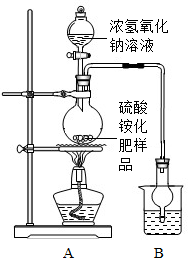
[交流讨论]
甲同学认为:应在实验装置中A、B装置间加装一个干燥装置,否则根据实验测得的数据,计算硫酸铵化肥的含氮量可能 (填“偏高”或“偏低”).
乙同学认为:改进后的实验装置中还存在另一个明显缺陷是: .
(经过大家充分讨论后,对实验装置进行了改进,重新进行实验.)
[探究结论]称取13.5 g硫酸铵化肥样品,用最终改进后的实验装置重新进行实验,经数据处理释放出氨气的质量与反应时间如图所示.试通过计算,判断该化肥的等级. (要求写出计算过程)
[工艺流程示意图]

上述流程中,沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
[讨论交流]
(1)操作a的名称是
(2)经操作a后得到的某物质在煅烧炉中发生反应的化学方程式为
(3)图中操作b应怎样进行呢?
查阅资料:右图是硫酸铵在水中的溶解度曲线.
表:固体硫酸铵在部分温度时的溶解度.
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 溶解度/g | 70.6 | 73 | 75.4 | 78 | 81 | 85 | 88 | ? | 95 | 98 | 103 |

下列说法正确的有
①从溶解度曲线中,可以查找70℃时硫酸铵的溶解度约90g;②图中的A点表示硫酸铵溶液的状态不饱和;③若将A点变成B点的操作采用加热蒸发、使溶液浓缩的方法④若将B点转化为C点时,采用的是冷却热饱和溶液方法
该化肥厂生产的硫酸铵化肥品质怎样呢?
[查阅资料]下表是硫酸铵化肥品质的主要指标.
| 指标项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥20.7% | ≥20.5% |
已知:(NH4)2SO4+2NaOH
| ||
[观察外观]该硫酸铵化肥无可见机械杂质.
[实验探究]按如图所示装置进行实验.
(1)实验过程中,为使硫酸铵充分反应完全转化为NH3,则需往烧瓶中加入足量浓氢氧化钠溶液并充分加热.
(2)选择右图装置A进行实验的原因

[交流讨论]
甲同学认为:应在实验装置中A、B装置间加装一个干燥装置,否则根据实验测得的数据,计算硫酸铵化肥的含氮量可能
乙同学认为:改进后的实验装置中还存在另一个明显缺陷是:
(经过大家充分讨论后,对实验装置进行了改进,重新进行实验.)
[探究结论]称取13.5 g硫酸铵化肥样品,用最终改进后的实验装置重新进行实验,经数据处理释放出氨气的质量与反应时间如图所示.试通过计算,判断该化肥的等级.
为了探究某化肥厂生产的硫酸铵化肥品质,实验小组的同不展开拓展研究.
【查阅资料】
①下表是硫酸铵化肥品质的主要指标.
②氨气极易溶于水,其水溶液为氨水,呈碱性.
③已知:(NH4)2SO4+2NaOH
Na2SO4+2NH3↑+2H2O
【观察外观】该硫酸铵化肥无可见机械杂质.
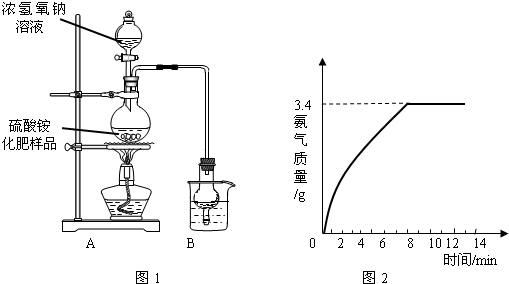
【实验探究】按如图所示装置进行实验.
(1)实验过程中,为使硫酸铵充分反应完全转化为NH3,则需往烧瓶中加入足量浓氢氧化钠溶液并充分加热.
(2)如图1装置A与实验室制取二氧化碳的装置比较最大的区别是 ,烧杯中盛放的试剂稀硫酸可以吸收氨气,两者通过化合反应生成一种盐,写出化学方程式 .
【交流讨论】
(1)甲同学认为:应在实验装置中A、B装置间加装一个干燥装置,该干燥装置中的干燥剂为 【A、浓硫酸B、碱石灰(氢氧化钠和氧化钙固体混合物)】,否则根据实验测得的数据,计算硫酸铵化肥的含氮量可能 (填“偏高”或“偏低”).
(2)乙同学认为:改进后的实验装置为增加氨气的吸收效果可将B装置改进为: .
(经过大家充分讨论后,对实验装置进行了改进,重新进行实验.)
【探究结论】称取13.5g硫酸铵化肥样品,取20%氢氧化钠溶液用最终改进后的实验装置重新进行实验,(杂质不反应也不溶于水),经数据处理释放出氨气的质量与反应时间如图2所示.通过计算可知该化肥样品中氮元素的质量分数为 ,则该化肥的等级为 .

【查阅资料】
①下表是硫酸铵化肥品质的主要指标.
| 指标项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥20.7% | ≥20.5% |
③已知:(NH4)2SO4+2NaOH
| ||
【观察外观】该硫酸铵化肥无可见机械杂质.
【实验探究】按如图所示装置进行实验.
(1)实验过程中,为使硫酸铵充分反应完全转化为NH3,则需往烧瓶中加入足量浓氢氧化钠溶液并充分加热.
(2)如图1装置A与实验室制取二氧化碳的装置比较最大的区别是
【交流讨论】
(1)甲同学认为:应在实验装置中A、B装置间加装一个干燥装置,该干燥装置中的干燥剂为
(2)乙同学认为:改进后的实验装置为增加氨气的吸收效果可将B装置改进为:
(经过大家充分讨论后,对实验装置进行了改进,重新进行实验.)
【探究结论】称取13.5g硫酸铵化肥样品,取20%氢氧化钠溶液用最终改进后的实验装置重新进行实验,(杂质不反应也不溶于水),经数据处理释放出氨气的质量与反应时间如图2所示.通过计算可知该化肥样品中氮元素的质量分数为
 某化学小组同学利用如图所示装置研究可燃物的燃烧条件.
某化学小组同学利用如图所示装置研究可燃物的燃烧条件.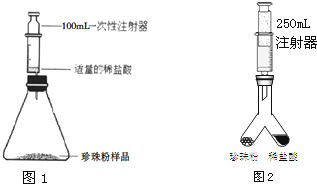
 某课外活动小组同学用如图所示的装置(固定装置未画出)测定含有杂质的石灰石样品中碳酸钙的质量分数(杂质与酸接触不产生气体).实验过程是:
某课外活动小组同学用如图所示的装置(固定装置未画出)测定含有杂质的石灰石样品中碳酸钙的质量分数(杂质与酸接触不产生气体).实验过程是: