题目内容
 如图A是铝元素在元素周期表中的相关信息,B是其原子结构示意图.
如图A是铝元素在元素周期表中的相关信息,B是其原子结构示意图.(1)铝的相对原子质量为
(2)铝的金属活动性比铁
考点:元素周期表的特点及其应用,金属的化学性质,原子结构示意图与离子结构示意图
专题:化学用语和质量守恒定律,金属与金属材料
分析:(1)原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层.若最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子;人体中含量最多的元素是氧元素,写出与铝元素组成化合物的化学式即可;
(2)根据铝的化学性质进行分析;铝表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化.
(2)根据铝的化学性质进行分析;铝表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化.
解答:解:(1)由铝元素在元素周期表中的相关信息,铝的相对原子质量为26.98;根据铝原子的结构示意图,其最外层电子数为3,在发生化学反应时易失去3个电子带上3个单位的正电荷,形成阳离子,铝离子的符号为Al3+;人体中含量最多的元素是氧元素,铝元素显+3价,氧元素显-2价,铝元素与人体中含量最多的元素组成的化合物的化学式为Al2O3.
(2)铝的金属活动性比铁强,但通常情况下铝制品很耐腐蚀,这是因为铝在常温下与空气中的氧气发生化学反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化.
故答案为:(1)26.98,阳,Al3+;Al2O3.
(2)强;铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化.
(2)铝的金属活动性比铁强,但通常情况下铝制品很耐腐蚀,这是因为铝在常温下与空气中的氧气发生化学反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化.
故答案为:(1)26.98,阳,Al3+;Al2O3.
(2)强;铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化.
点评:本题难度不大,掌握元素周期表与原子结构示意图及其意义、离子符号与化学式的书写等是正确解答本题的关键.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
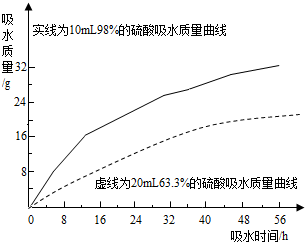 硫酸是常见的酸,也是常用的化工原料.由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等.某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验.请结合有关实验,按要求回答下列问题:
硫酸是常见的酸,也是常用的化工原料.由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等.某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验.请结合有关实验,按要求回答下列问题: