题目内容
小强和小明两位同学在实验室用下列装置制取几种气体.
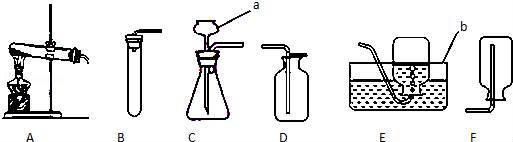

(1)写出图中有标号仪器的名称:a是 ,b是 .
(2)小强想用高锰酸钾制取一瓶氧气应选用的发生装置是 (填装置序号),而小明认为该装置有一个小问题,请你帮助他: ;实验室用该方法制取氧气的化学方程式是 .
(3)在装入药品前,应先进行的一项操作是 .
(4)小明要制取少量CO2,其反应原理是 (用化学方程式表示),他收集该气体的装置是(填装置序号) ,选用该装置的理由是.
(5)为了防止生成的气体从C装置仪器a逸出,必须使a仪器 .
(6)小强和小明还对过氧化氢分解时影响反应速率的部分因素作出探究,并测得相关实验数据.如下表:
实验序号 H2O2溶液浓度% H2O2溶液体积/mL 温度/℃ MnO2的用量/g 收集氧气的体积/mL(排水法) 反应所需时间/s
① 5 1 20 0.1 2 16.75
② 15 1 20 0.1 2 12.63
③ 20 5 25 0.2 4 10.70
④ 20 5 35 0.2 4 8.06
从实验③和④对比可知,化学反应速率与 有关.通过实验①与②对比可知,化学反应速率与反应物的有关.若用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,加适量水稀释,产生氧气的总质量 .要熟悉各种仪器的名称、用途和使用方法;
(2)高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气;
(3)凡是有气体参加或产生的实验,实验前一定要检查装置的气密性;
(4)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;二氧化碳能够溶于水,密度比空气大;
(5)不同的实验装置,功能不同.
(6)③④是温度不同其他条件相同,是对温度影响化学反应速度的探究;①②是过氧化氢浓度不同而其他条件相同,这种设计是验证反应物浓度对反应速度的影响;从表中分析可知:①②是过氧化氢浓度不同而其他的反应时各种量均相同,可知这一过程是考查反应物的浓度与反应速度的关系.
【解答】解:(1)a是长颈漏斗,通过长颈漏斗可以向反应容器中注入液体药品;b是水槽,常用于排水法收集气体;
(2)用高锰酸钾制取氧气需要加热,应该用A装置作为发生装置;为了防止高锰酸钾进入导管,应该在试管口塞一团棉花;高锰酸钾受热分解的化学方程式为:2KMnO4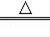
 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3)为了防止装置漏气影响实验,在装入药品前,应先检查装置的气密性;
(4)碳酸钙和稀盐酸反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;二氧化碳能够溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集,即用D装置收集;
(5)为了防止生成的气体从仪器a中逸出,必须使a仪器的末端浸没在液体中;
(6)从表中分析可知:③④是温度不同其他条件相同,明显是对温度影响化学反应速度的探究;①②是过氧化氢浓度不同而其他的反应时各种量均相同,可知这一过程是考查反应物的浓度与反应速度的关系;从表中分析可知:①②是过氧化氢浓度不同而其他的反应时各种量均相同,可知这一过程是考查反应物的浓度与反应速度的关系,且反应物的浓度越大,化学反应速率越快,所以用一定量的质量分数为15%的过氧化氢溶液制氧气,在不影响产生氧气质量的前提下,为了减慢反应速率,可采取加水稀释过氧化氢溶液的措施,故加适量水稀释,产生氧气的总质量不变.
故答案为:(1)长颈漏斗、水槽;
(2)A、在试管口塞一团棉花、2KMnO4
 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3)检查装置气密性;
(4)CaCO3+2HCl=CaCl2+CO2↑+H2O、D;
(5)下端管口伸入液面以下;
(6)温度、不变.
【点评】本题主要考查仪器的用途、化学方程式的书写,实验装置的选择,选择发生装置时,要考虑反应物的状态、反应条件等因素;选择收集装置时,要考虑气体的水溶性、能否和水发生化学反应、密度、能否和空气中的物质发生化学反应等因素.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为:
FexOy+yH2 3Fe+yH2O
3Fe+yH2O
Fe3C+2H2 3Fe+CH4
3Fe+CH4
(1)焙烧中加焦炭的作用:① ;② .
(2)写出焙烧中氧化铁与CO反应的化学方程式: .
【含量测定】为得到精还原铁粉并测定粗还原铁粉中铁的氧化物组成及Fe3C的质量分数,取粗还原铁粉16g,并将其分为2等分,一份与足量的稀盐酸反应,得到氢气0.2g,另一份按如下装置进行实验.(假设每步反应都完全且不考虑装置内原有空气对测定结果的影响).
【资料卡】①3CH4+4Fe2O3 3CO2+6H2O+8Fe
3CO2+6H2O+8Fe
②铁的氧化物及Fe3C均不能与稀盐酸反应产生H2
③浓硫酸的作用吸水,碱石灰吸水和二氧化碳

(3)写出装置中所指定仪器的名称:① ;② .
(4)写出铁与稀盐酸反应的化学方程式: .
(5)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,精确称量样品和B、D、E装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灭A、C处酒精灯;⑥再缓缓通入少量H2;⑦再次精确称量样品及B、D、E装置的质量.
正确操作的先后顺序是①→③→④→②→⑤→⑥→⑦(填序号),否则,测定的Fe3C质量分数 (填“偏大”、“偏小”或“不变”).步骤③的目的是 ,验证该步骤目的达到的实验方法是收集 ;步骤⑥的目的是防 .
(6)经精确称量,实验样品及B、D、E装置反应前后质量的变化如表:
| 样品 | B | D | E | |
| 反应前 | 8g | 350g | 350g | 220g |
| 反应后 | 7.553g | 350.435g | 351.98g | 220.22g |
计算样品中Fe3C质量分数,应选用上表中的 组数据(填“D”或“E”),其理由是 ,则Fe3C质量分数为 (精确到0.01%).
(7)样品中铁的氧化物中,铁、氧元素的质量比是多少?(精确到0.01)(写出计算过程)
要学会从化学的视角认识世界,对下列事实的解释错误的是( )
| 事实 | 解释 | |
| A | 香水、汽油要密封保存 | 分子不断地运 动 |
| B | 湿衣服晾在太阳底下干得快 | 分子运动速率与温度有关 |
| C | 6000L氧气加压可装入容积为40L的钢瓶 | 分子之间有间隙 |
| D | 物体热胀冷缩 | 分子大小随温度而改变 |
A.A B.B C.C D.D



 O
O