题目内容
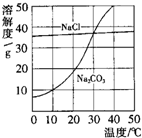
如图为氯化钠、碳酸钠在水中的溶解度曲线.
请回答下列问题:
(1)30℃时,氯化钠的溶解度碳酸钠的溶解度(填写“>”、“<”或“=”);
(2)[10℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、碳酸钠两种物质,至不再溶解为止,所得溶液的溶质质量分数大的是溶液;
(3)如图所示,20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.加入的物质可能是(填字母序号).

A.氢氧化钠 B.生石灰 C.硝酸铵 D.浓硫酸.
【答案】分析:(1)曲线交点表示两物质溶解度相等;
(2)根据饱和溶液的溶质质量分数与溶解度之间的关系进行比较;
(3)根据物质溶解度与温度之间的关系及物质溶解时的吸放热现象解答.
解答:解:(1)30℃时,两物质的溶解度曲线相交于一点,说明该温度下氯化钠的溶解度等于碳酸钠的溶解度.
(2)10℃时,氯化钠的溶解度大于碳酸钠的溶解度,根据饱和溶液的溶质质量分数=溶解度/100g+溶解度×100%,可知同温下,溶解度越大,对于该物质饱和溶液的溶质质量分数越大,因此10℃时氯化钠饱和溶液的溶质质量分数大于碳酸钠饱和溶液的溶质质量分数.
(3)已知碳酸钠的溶解度随温度的升高而明显增加,20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出,说明一定是溶液的温度降低而引起的,氢氧化钠、浓硫酸、生石灰溶于水都放出热量,温度升高,硝酸铵溶于水温度降低,故选C;
故答案为:(1)=;(2)NaCl; (3)C
点评:溶解度曲线能定量地表示出溶解度变化的规律.从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同.
(2)根据饱和溶液的溶质质量分数与溶解度之间的关系进行比较;
(3)根据物质溶解度与温度之间的关系及物质溶解时的吸放热现象解答.
解答:解:(1)30℃时,两物质的溶解度曲线相交于一点,说明该温度下氯化钠的溶解度等于碳酸钠的溶解度.
(2)10℃时,氯化钠的溶解度大于碳酸钠的溶解度,根据饱和溶液的溶质质量分数=溶解度/100g+溶解度×100%,可知同温下,溶解度越大,对于该物质饱和溶液的溶质质量分数越大,因此10℃时氯化钠饱和溶液的溶质质量分数大于碳酸钠饱和溶液的溶质质量分数.
(3)已知碳酸钠的溶解度随温度的升高而明显增加,20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出,说明一定是溶液的温度降低而引起的,氢氧化钠、浓硫酸、生石灰溶于水都放出热量,温度升高,硝酸铵溶于水温度降低,故选C;
故答案为:(1)=;(2)NaCl; (3)C
点评:溶解度曲线能定量地表示出溶解度变化的规律.从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
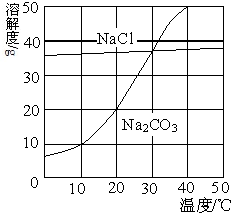
 如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题:
如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题: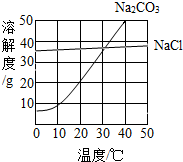 (2013?佛山)如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题;
(2013?佛山)如图为氯化钠、碳酸钠在水中的溶解度曲线.请回答下列问题;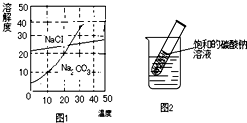 如图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线.
如图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线.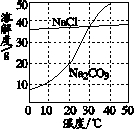 如图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线,请回答问题.
如图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线,请回答问题.