题目内容
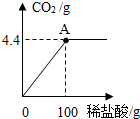 (2011?梧州)广西具有丰富的石灰石资源.化学兴趣小组欲测定某石灰石样品中CaCO3的质量分数,取石灰石样品15g,加入适量稀盐酸(杂质不溶于水,也不与盐酸反应),消耗稀盐酸的质量与放出二氧化碳的质量关系如图所示,请你计算:
(2011?梧州)广西具有丰富的石灰石资源.化学兴趣小组欲测定某石灰石样品中CaCO3的质量分数,取石灰石样品15g,加入适量稀盐酸(杂质不溶于水,也不与盐酸反应),消耗稀盐酸的质量与放出二氧化碳的质量关系如图所示,请你计算:(1)CaCO3的相对分子质量
(2)该石灰石样品中CaCO3的质量分数
(3)A点时所得溶液的溶质质量分数.
分析:根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.在本题中,由图象可知:产生的二氧化碳的质量是4.4g,根据二氧化碳的质量可以求出碳酸钙的质量和生成的氯化钙的质量,然后再求CaCO3的质量分数和所得溶液的溶质质量分数.
解答:解:(1)40+12+16×3=100,故答案为:100
(2)由图象可知:产生的二氧化碳的质量是4.4g,设碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
=
x=10g
石灰石样品中CaCO3的质量分数为:
×100%=66.7%
答:石灰石样品中CaCO3的质量分数66.7%
故答案为:66.7%
(3)设生成氯化钙的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
111 44
y 4.4g
=
y=11.1g
A点时所得溶液的溶质质量分数为:
×100%=10.5%
答:A点时所得溶液的溶质质量分数10.5%
故答案为:10.5%
(2)由图象可知:产生的二氧化碳的质量是4.4g,设碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
| 100 |
| x |
| 44 |
| 4.4g |
x=10g
石灰石样品中CaCO3的质量分数为:
| 10g |
| 15g |
答:石灰石样品中CaCO3的质量分数66.7%
故答案为:66.7%
(3)设生成氯化钙的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
111 44
y 4.4g
| 111 |
| y |
| 44 |
| 4.4g |
A点时所得溶液的溶质质量分数为:
| 11.1g |
| 10g+100g-4.4g |
答:A点时所得溶液的溶质质量分数10.5%
故答案为:10.5%
点评:本考点考查了根据化学方程式的计算和质量守恒定律,属于溶质的质量分数和化学方程式的综合应用.图象型计算题是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律.本考点主要出现在计算题中.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2011?梧州模拟)如图是某品牌奶粉的营养成分表,由表中可知
(2011?梧州模拟)如图是某品牌奶粉的营养成分表,由表中可知 (2011?梧州模拟)已知甲、乙为两种黑色粉末,丙是一种红色固体,丁为一种蓝色溶液的溶质,A是一种能使澄清石灰水变浑浊的气体,它们的相互转化关系如图所示.请用正确的化学式填空:
(2011?梧州模拟)已知甲、乙为两种黑色粉末,丙是一种红色固体,丁为一种蓝色溶液的溶质,A是一种能使澄清石灰水变浑浊的气体,它们的相互转化关系如图所示.请用正确的化学式填空: