题目内容
现有NaCl和CaCl2的固体混合物共14g,加入96g Na2CO3溶液恰好完全反应,待反应完全后过滤、干燥、称得沉淀为10g.
(1)固体混合物中CaCl2的质量为多少?
(2)所得溶液中溶质的质量分数是多少?
解:(1)设固体混合物中CaCl2的质量为x,反应后生成NaCl的质量为y.
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100 117
x 10g y

x=11.1g

y=11.7g
(2)所得溶液中溶质的质量分数= ×100%=14.6%
×100%=14.6%
答:(1)固体混合物中CaCl2的质量为11.1g;
(2)所得溶液中溶质的质量分数为14.6%.
分析:(1)欲求原固体混合物中CaCl2的质量,根据碳酸钙的质量可根据已知条件求出;
(2)根据溶质的质量分数=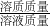 ×100%,可以求出滤液中溶质的质量分数.
×100%,可以求出滤液中溶质的质量分数.
点评:本题主要考查学生对常见物质的性质的了解,以及各物质之间的反应的掌握情况.学生要认真分析各物质之间的反应的情况,正确书写化学方程式,才能解答.
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100 117
x 10g y

x=11.1g

y=11.7g
(2)所得溶液中溶质的质量分数=
 ×100%=14.6%
×100%=14.6%答:(1)固体混合物中CaCl2的质量为11.1g;
(2)所得溶液中溶质的质量分数为14.6%.
分析:(1)欲求原固体混合物中CaCl2的质量,根据碳酸钙的质量可根据已知条件求出;
(2)根据溶质的质量分数=
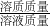 ×100%,可以求出滤液中溶质的质量分数.
×100%,可以求出滤液中溶质的质量分数.点评:本题主要考查学生对常见物质的性质的了解,以及各物质之间的反应的掌握情况.学生要认真分析各物质之间的反应的情况,正确书写化学方程式,才能解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
通过化学实验鉴别物质的存在,现象分析和推理过程是十分重要的.现有固体混合物一包,可能由KNO3、NaCl、K2SO4、BaSO4、CaCl2、Na2CO3中的一种或几种组成,依次进行实验,请完成如下实验记录分析报告.
问:(1)步骤④推理分析是否正确,如果不正确,说明原因,如果正确不用论述:______
(2)固体混合物不一定含有______.
| 实验步骤 | 观察现象 | 对应的推理和分析 |
| ①向混合物中加入适量水 | 全部溶解,溶液 无色透明 | ①一定没有______ |
| ②向步骤①溶液中滴加过量BaCl2溶液 | 白色沉淀 | ②可能有______ |
| ③取步骤②的白色沉淀,加入稀盐酸 | 白色沉淀全部消失 | ③一定有______ |
| ④在步骤②的浊液中滴加 过量AgNO3溶液和稀HNO3 | 白色沉淀 | ④一定有NaCl和CaCl2 |
(2)固体混合物不一定含有______.
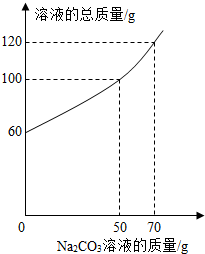 将14.4g由NaCl和CaCl2组成的固体混合物溶于水配成60g溶液,向所得到的混合溶液中逐滴加入一定质量分数的Na2CO3溶液,所加入Na2CO3溶液的质量与所得溶液的总质量关系如图:
将14.4g由NaCl和CaCl2组成的固体混合物溶于水配成60g溶液,向所得到的混合溶液中逐滴加入一定质量分数的Na2CO3溶液,所加入Na2CO3溶液的质量与所得溶液的总质量关系如图: