题目内容
4.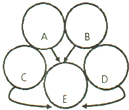 A、B是初中常见的酸和碱,且反应产生白色沉淀,C、D、E是三种常见的氧化物,C通常情况下为气体,如图用圆表示这五种物质,用两圆相切表示两种物质可以发生化学反应,用“→”表示一种物质能转化为另一种物质.
A、B是初中常见的酸和碱,且反应产生白色沉淀,C、D、E是三种常见的氧化物,C通常情况下为气体,如图用圆表示这五种物质,用两圆相切表示两种物质可以发生化学反应,用“→”表示一种物质能转化为另一种物质.请回答下列问题:
(1)在图中标出五种物质的化学式;A、Ba(OH)2B、H2SO4C、CO2D、CaOE、H2O
(2)D与E反应的化学方程式为CaO+H2O=Ca(OH)2
(3)A与C反应的实验现象为无色溶液中产生白色沉淀.
分析 根据A、B是初中常见的酸和碱,且反应产生白色沉淀和氧化物E,所以E是水,气体氧化物C和A会反应,所以A可以是氢氧化钡,B可以是硫酸,C会与水反应,氧化物D会与水反应,氧化物C、D都会转化成水,所以C可以是二氧化碳,D是氧化钙,然后将推出的物质进行验证即可.
解答 解:(1)A、B是初中常见的酸和碱,且反应产生白色沉淀和氧化物E,所以E是水,气体氧化物C和A会反应,所以A可以是氢氧化钡,B可以是硫酸,C会与水反应,氧化物D会与水反应,氧化物C、D都会转化成水,所以C可以是二氧化碳,D是氧化钙,氢氧化钡和硫酸反应生成硫酸钡沉淀和水,氢氧化钡和二氧化碳反应生成碳酸钡沉淀和水,二氧化碳和水反应生成碳酸,硫酸和氧化钙反应生成硫酸钙和水,氧化钙和水反应生成氢氧化钙,推出的各物质物质均满足题意,推导合理,所以
(2)D与E的反应是氧化钙和水生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2;
(3)通过推导可知,A是氢氧化钡,B是硫酸,氢氧化钡和硫酸反应会生成白色的硫酸钡沉淀和水,所以A与B反应的实验现象为:生成白色沉淀.
故答案为:(1)A、Ba(OH)2 B、H2SO4 C、CO2 D、CaO E、H2O ;
;
(2)CaO+H2O=Ca(OH)2;
(3)无色溶液中产生白色沉淀.
点评 本题属于常见物质的推断题,在解此类题时,首先分析所给物质两两之间的反应,然后结合题中的转化关系分析解答,最后进行验证即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.将硫酸渣中金属元素进行分离的一种工艺 流程如图所示.

【查阅资料】
Ⅰ.相关数据
25℃时,氢氧化物沉淀的pH范围
Ⅱ.25℃时,Al(OH)3可溶于pH>6.0的碱溶液,并转化为AlO2-
【流程分析】
(1)在实验室完成操作①需要的玻璃仪器有烧杯、玻璃棒和漏斗.
(2)所加稀盐酸必须过量的原因是使硫酸渣完全溶解.
(3)向溶液A中加入试剂M调节pH到7的过程中,沉淀的颜色会经历“红褐色变淡,再变深的过程”的过程,出现该现象的原因是氢氧化钠会与氯化铁反应生成氢氧化铁沉淀,氢氧化铁沉淀会溶于酸,盐酸消耗完后,氢氧化铁沉淀的沉淀量会逐渐增多,颜色变深.
(4)溶液B中加入试剂M调节pH=13时,发生反应的化学方程式是AlCl3+4NaOH=NaAlO2+2H2O+3NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
(5)高温灼烧固体X时,X能在保持各元素的化合价不变的前提下分解为两种氧化物,该反应的化学方程式是2Fe(OH)3$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2O.
(6)如果操作②是蒸发结晶,则不可能得到纯净的NaAlO2固体,理由是溶液C中含有反应生成的氯化钠.
Ⅲ.1000t该硫酸渣含铁的质量分数37.75%,经过充分处理后,最多可以冶炼得到含杂质4%的生铁多少吨?

【查阅资料】
Ⅰ.相关数据
25℃时,氢氧化物沉淀的pH范围
| Fe(OH)3 | Al(OH)3 | Mg(OH)2 | |
| 开始沉淀时的pH | 1.5 | 3.3 | 10.4 |
| 沉淀完全时的pH | 3.2 | 5.2 | 12.4 |
【流程分析】
(1)在实验室完成操作①需要的玻璃仪器有烧杯、玻璃棒和漏斗.
(2)所加稀盐酸必须过量的原因是使硫酸渣完全溶解.
(3)向溶液A中加入试剂M调节pH到7的过程中,沉淀的颜色会经历“红褐色变淡,再变深的过程”的过程,出现该现象的原因是氢氧化钠会与氯化铁反应生成氢氧化铁沉淀,氢氧化铁沉淀会溶于酸,盐酸消耗完后,氢氧化铁沉淀的沉淀量会逐渐增多,颜色变深.
(4)溶液B中加入试剂M调节pH=13时,发生反应的化学方程式是AlCl3+4NaOH=NaAlO2+2H2O+3NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
(5)高温灼烧固体X时,X能在保持各元素的化合价不变的前提下分解为两种氧化物,该反应的化学方程式是2Fe(OH)3$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2O.
(6)如果操作②是蒸发结晶,则不可能得到纯净的NaAlO2固体,理由是溶液C中含有反应生成的氯化钠.
Ⅲ.1000t该硫酸渣含铁的质量分数37.75%,经过充分处理后,最多可以冶炼得到含杂质4%的生铁多少吨?
12.选择铸造硬币的金属材料不需要考虑的因素是( )
| A. | 耐腐蚀性 | B. | 导电性 | C. | 价格 | D. | 硬度 |
19.在实验室进行下列各种物质的鉴别,其中涉及的方案均合理的是( )
| A | B | C | D | |
| 实验要求 | 区分饱和的氯化钠溶液和不饱和氯化钠溶液 | 区分碳粉和铁粉 | 区分酒精溶液和蒸馏水 | 区分硬水和软水 |
| 第一方案 | 升高温度 | 分别在空气中灼烧 | 测导电性 | 观察颜色 |
| 第二方案 | 加入氯化钠固体 | 分别用磁铁吸 | 闻气味 | 加肥皂水 |
| A. | A | B. | B | C. | C | D. | D |
9.关于各元素相对含量说法正确的是( )
| A. | 地壳中含量最高的元素是铝 | B. | 人体中含量最高的元素是氢 | ||
| C. | 空气中含量最高的元素是氧 | D. | 海洋中含量最高的元素是氧 |
16.相同质量的CO和CO2中,碳元素的质量比是( )
| A. | 1:1 | B. | 14:11 | C. | 7:11 | D. | 11:7 |
13.(1)目前,人类以化石燃料为主要能源.化石燃料有煤、石油和天然气,它们都属于不可再生(填“可再生”或“不可再生”)能源.
(2)天然气中甲烷完全燃烧的化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O..
(3)从表中数据分析,与煤相比,用天然气作燃料的优点有产生的二氧化碳少,放出的热量多.
(2)天然气中甲烷完全燃烧的化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O..
(3)从表中数据分析,与煤相比,用天然气作燃料的优点有产生的二氧化碳少,放出的热量多.
| 1g物质完全燃烧 | ||
| 产生二氧化碳的质量/g | 放出的热量/kJ | |
| 甲烷 | 2.75 | 56 |
| 煤 | 3.67 | 32 |