题目内容
金属材料是重要的资源,请根据你所学的相关知识,回答下列问题:
(1)铁锅可用于炒菜是利用了铁的 性.炒菜时锅中不慎着火可用锅盖盖灭,原理是
(2)铜质的器皿长期暴露在潮湿空气中会被氧化长出一层绿色的铜锈,对铜具有保护作用,因此,室外铜工艺品、铜导线管路等往往不需要予以专门的保护.铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3].若该物质通过化合反应生成,反应物除 Cu外,还有
①N2 ②O2 ③CO2 ④H2O 中的
A.一种B.两种C.三种D.四种
(3)在实验室里,小明同学设计方案用铁钉测定某废液中盐酸的质量分数.他先取一质量为35.2g的洁净小烧杯,往其中倒入少量盐酸废液后称量,总质量108.2g,之后将一枚质量为 10.8g 的铁钉(已用砂纸打磨去除铁锈)放入该小烧杯中反应,待铁钉表面不再有气泡产生后,再次称量,总质量为 118.8 g.请回答下列问题:
①反应中产生的气体的质量是 .
②计算该废液中盐酸的质量分数 .
③若铁钉的铁锈未除净,烧杯中会先发生另一个反应,化学方程式是 ,
这样会对盐酸质量分数的计算结果有影响,使得其 (选填“偏大”、“偏小”),理由是 .
(1)铁锅可用于炒菜是利用了铁的
(2)铜质的器皿长期暴露在潮湿空气中会被氧化长出一层绿色的铜锈,对铜具有保护作用,因此,室外铜工艺品、铜导线管路等往往不需要予以专门的保护.铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3].若该物质通过化合反应生成,反应物除 Cu外,还有
①N2 ②O2 ③CO2 ④H2O 中的
A.一种B.两种C.三种D.四种
(3)在实验室里,小明同学设计方案用铁钉测定某废液中盐酸的质量分数.他先取一质量为35.2g的洁净小烧杯,往其中倒入少量盐酸废液后称量,总质量108.2g,之后将一枚质量为 10.8g 的铁钉(已用砂纸打磨去除铁锈)放入该小烧杯中反应,待铁钉表面不再有气泡产生后,再次称量,总质量为 118.8 g.请回答下列问题:
①反应中产生的气体的质量是
②计算该废液中盐酸的质量分数
③若铁钉的铁锈未除净,烧杯中会先发生另一个反应,化学方程式是
这样会对盐酸质量分数的计算结果有影响,使得其
考点:金属的物理性质及用途,有关溶质质量分数的简单计算,金属锈蚀的条件及其防护,根据化学反应方程式的计算,灭火的原理和方法
专题:溶质质量分数与化学方程式相结合的计算,金属与金属材料
分析:(1)由铁具有导热性;盖上锅盖后,隔绝了氧气,使火熄灭去分析;
(2)由于铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它是由碳元素、氧元素、氢元素、铜元素四种元素组成的.根据质量守恒定律,反应前后元素的种类不变去分析;
(3)①由于铁和盐酸反应生成氢气,所以反应后烧杯中物质的质量减小,故生成氢气的质量为:(108.2g+10.8g)-118.8g=0.2g;故答案为:0.2g;
②根据生成氢气的质量利用化学方程式求出所用废液中盐酸中溶质的质量分数;
③若铁钉的铁锈未除净,铁锈和盐酸反应会生成氯化铁和水;由上面②的分析可以看出:求废液中盐酸的质量分数是根据氢气的质量来进行计算的.若铁钉的铁锈未除净,铁锈会和一部分盐酸反应,但此时没有产生氢气;这样和铁锈反应的稀盐酸中溶质的质量没有计算在内去分析.
(2)由于铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它是由碳元素、氧元素、氢元素、铜元素四种元素组成的.根据质量守恒定律,反应前后元素的种类不变去分析;
(3)①由于铁和盐酸反应生成氢气,所以反应后烧杯中物质的质量减小,故生成氢气的质量为:(108.2g+10.8g)-118.8g=0.2g;故答案为:0.2g;
②根据生成氢气的质量利用化学方程式求出所用废液中盐酸中溶质的质量分数;
③若铁钉的铁锈未除净,铁锈和盐酸反应会生成氯化铁和水;由上面②的分析可以看出:求废液中盐酸的质量分数是根据氢气的质量来进行计算的.若铁钉的铁锈未除净,铁锈会和一部分盐酸反应,但此时没有产生氢气;这样和铁锈反应的稀盐酸中溶质的质量没有计算在内去分析.
解答:解:(1)由于铁具有导热性,所以铁锅内的饭菜可做熟,炒菜时锅中不慎着火用锅盖盖灭,是因为盖上锅盖后,隔绝了氧气,使火熄灭;
故答案为:导热 隔绝氧气;
(2)由于铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它是由碳元素、氧元素、氢元素、铜元素四种元素组成的.根据质量守恒定律,反应前后元素的种类不变,由于是通过化合反应生成,故反应物除 Cu外,其他的反应物中应含有碳元素、氢元素和氧元素,故反应物中应含有空气中的水分、二氧化碳和氧气三种;故答案为:C;
(3)①由于铁和盐酸反应生成氢气,所以反应后烧杯中物质的质量减小,故生成氢气的质量为:(108.2g+10.8g)-118.8g=0.2g;故答案为:0.2g;
②解:设该废液中盐酸的质量分数为x,
Fe+2HCl═FeCl2 +H2↑
73 2
(108.2g-35.2g)×X 0.2g
=
解之得:
X=10%
故答案为:10%.
③若铁钉的铁锈未除净,铁锈和盐酸反应会生成氯化铁和水,其化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;由上面②的分析可以看出:求废液中盐酸的质量分数是根据氢气的质量来进行计算的.若铁钉的铁锈未除净,铁锈会和一部分盐酸反应,但此时没有产生氢气;这样和铁锈反应的稀盐酸中溶质的质量没有计算在内,就会导致所求的稀盐酸的溶质的质量分数变小;故答案为:Fe2O3+6HCl=2FeCl3+3H2O 偏小 和铁锈反应的盐酸中的溶质的质量没有计算在内.
故答案为:导热 隔绝氧气;
(2)由于铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3],它是由碳元素、氧元素、氢元素、铜元素四种元素组成的.根据质量守恒定律,反应前后元素的种类不变,由于是通过化合反应生成,故反应物除 Cu外,其他的反应物中应含有碳元素、氢元素和氧元素,故反应物中应含有空气中的水分、二氧化碳和氧气三种;故答案为:C;
(3)①由于铁和盐酸反应生成氢气,所以反应后烧杯中物质的质量减小,故生成氢气的质量为:(108.2g+10.8g)-118.8g=0.2g;故答案为:0.2g;
②解:设该废液中盐酸的质量分数为x,
Fe+2HCl═FeCl2 +H2↑
73 2
(108.2g-35.2g)×X 0.2g
| 73 |
| 2 |
| (108.2g-35.2g)×x |
| 0.2g |
解之得:
X=10%
故答案为:10%.
③若铁钉的铁锈未除净,铁锈和盐酸反应会生成氯化铁和水,其化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;由上面②的分析可以看出:求废液中盐酸的质量分数是根据氢气的质量来进行计算的.若铁钉的铁锈未除净,铁锈会和一部分盐酸反应,但此时没有产生氢气;这样和铁锈反应的稀盐酸中溶质的质量没有计算在内,就会导致所求的稀盐酸的溶质的质量分数变小;故答案为:Fe2O3+6HCl=2FeCl3+3H2O 偏小 和铁锈反应的盐酸中的溶质的质量没有计算在内.
点评:本题综合性较强,考查了铜生锈的原理、根据化学方程式进行计算等,分析出氢气的质量是解决本题的关键.

练习册系列答案
相关题目
下列四种物质各100g:①KMnO4 ②KClO3(另加少量MnO2)③HgO④H2O2 (另加少量MnO2);完全反应后,所放出的氧气质量由多到少的顺序是( )
| A、①>②>③>④ |
| B、④>②>①>③ |
| C、④>①>③>② |
| D、②>③>④>① |
在一只密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,下列说法正确的是( )
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 8 | 2 | 40 | 5 |
| 反应后质量/g | 待测 | 24 | 8 | 23 |
| A、反应后X的质量为0 |
| B、Y、Q的相对分子质量比一定为11:9 |
| C、参加反应的X、Z的质量比为1:5 |
| D、该密闭容器中发生的化学变化属于分解反应 |
下列物质中均含有氮元素,它们按下列顺序排列:①NH3 ②N2 ③NO ④X ⑤KNO3.根据这种排列规律,X可能是( )
| A、N2O |
| B、HNO3 |
| C、NO2 |
 如何合理、高效、节约地使用煤、石油、天然气这三大当今世界最主要的化石燃料,加紧开发、研制其它清洁能源是全人类面临的共同课题,是发展低碳经济的当务之急.回答下列问题:
如何合理、高效、节约地使用煤、石油、天然气这三大当今世界最主要的化石燃料,加紧开发、研制其它清洁能源是全人类面临的共同课题,是发展低碳经济的当务之急.回答下列问题: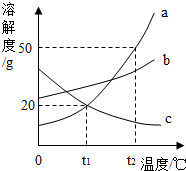 如图是a、b、c三种固体物质的溶解度曲线.
如图是a、b、c三种固体物质的溶解度曲线.