题目内容
【题目】A、B、C、D、E、F是初中化学中常见的物质,它们之间的转化关系如图。其中A、D为单质,且A具有还原性,D是目前世界年产量最高的金属。C是地球上最多的液态氧化物。F可用于改良酸性土壤,G为蓝色溶液(部分反应条件、反应物和生成物均已略去)。
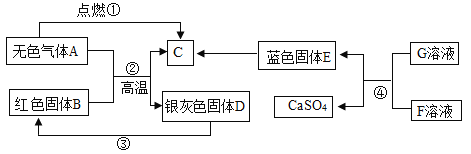
请回答:
(1)写出下列物质的化学式:A______ B_______;C________;E______。
(2)反应①是未来最好获得能量的方式,请写出A作为新能源的一个优点:________。
(3)反应②④反应的化学方程式:②___________;④____________。
【答案】H2 Fe2O3 H2O Cu(OH)2 燃烧产物是水,无污染 
![]()
【解析】
A、B、C、D、E、F是初中化学中常见的物质,D是目前世界年产量最高的金属,可推出D为铁,C是地球上最多的液态氧化物,可推出C为水,无色气体A可与红色固体B在高温下反应生成铁和水,且A为单质,可推出A为氢气,B为三氧化二铁,F可用于改良酸性土壤,可推出F为氢氧化钙,G为蓝色溶液,且G可与氢氧化钙反应生成蓝色固体E和硫酸钙,可推出G为硫酸铜,E为氢氧化铜。
(1)A为氢气,化学式为:H2;B为三氧化二铁,化学式为:Fe2O3;C为水,化学式为:H2O;E为氢氧化铜,化学式为:Cu(OH)2;
(2)氢能作为新能源的优点有:燃烧后的产物是水,不污染空气;
(3)反应②为三氧化二铁与氢气在高温下反应生成铁和水,该反应的化学方程式为: ;
;
反应④为氢氧化钙与硫酸铜反应生成氢氧化铜沉淀和硫酸钙,该反应的化学方程式为:![]() 。
。

【题目】一定条件下,测得反应前后各物质的质量变化如下表所示,其中甲和丁的相对分子质量之比为8:9。下列说法中,正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 2.0 | 20.0 | 3.0 | 20 |
反应后质量/g | 10.0 | x | 3.0 | 29.0 |
A.表中x=17
B.该反应中乙可能是单质
C.该反应中丙一定起催化作用
D.该反应的化学方程式中甲和丁的化学计量数之比为1:1
【题目】常见金属在氧气中能剧烈燃烧。某化学探究小组对“铁丝在氧气中燃烧为什么会火星四射”有兴趣。于是进行了如下探究:
(提出问题)铁丝在氧气中燃烧会火星四射与哪些因素有关呢?
(猜想与假设)猜想一:可能与金属的沸点有关;猜想二:可能与氧气的浓度有关;猜想三:可能与铁中含碳量有关。
(查阅资料)镁的沸点为1107℃;铁的沸点为2705℃。
(设计并实验)该探究小组用将镁丝、纯细铁丝和两种不同含碳量的细铁丝(镁丝和铁丝直径均为0.4mm)分别放入空气和氧气中燃烧。记录燃烧时的现象如下表。
实验序号 | 氧气纯度(含氧量) | 镁丝 | 铁丝中含碳量 | 燃烧时的现象 |
① | 空气中(21%) | 剧烈燃烧,发出耀眼白光,无火星 | 0%(纯铁) | 不燃烧 |
② | 纯氧中(100%) | 更剧烈燃烧,发出耀眼白光,无火星 | 0%(纯铁) | 剧烈燃烧,无火星 |
③ | 纯氧中(100%) | 更剧烈燃烧,发出耀眼白光,无火星 | 0.05% | 剧烈燃烧,极少火星 |
④ | 纯氧中(100%) | 更剧烈燃烧,发出耀眼白光,无火星 | 0.6% | 剧烈燃烧,火星四射 |
(收集证据)(1)若要比较细铁丝燃烧的剧烈程度与氧气的纯度有关,应选择的实验编号组合是_____。由实验③和④对比可知,产生火星四射的现象与细铁丝中含碳量的关系:_____。
(解释与结论)(2)通过探究,了解细铁丝在纯净的氧气燃烧时会火星四射的原因。请写出细铁丝在氧气中燃烧生成黑色的四氧化三铁固体的化学方程式为:_____。
(3)细铁丝中含有不同的含碳量,碳元素在燃烧过程中生成二氧化碳气体,将反应生成的熔化物四氧化三铁推了出去,从而产生了火星四射的现象。为保证实验成功,选用的铁丝中含碳量要控制的范围为_____。
(4)取一段含碳量0.6%的细铁丝绕成螺旋状,投入盛有足量的稀盐酸的烧杯中充分反应,可观察的现象为_____,并在烧杯底有少量的黑色残渣,其化学式为C。
【题目】某兴趣小组在学习氧气的化学性质时,发现不同物质在氧气中燃烧现象不同。

(1)下列物质在氧气中燃烧产物为气体的是_____(填序号)。
A.红磷 B.铁丝 C.木炭 D.硫粉
(2)铁丝在氧气中燃烧的化学方程式:_____。
(3)铁丝在氧气中燃烧没有火焰,而蜡烛在氧气中燃烧却有明亮的火焰。该小组同学进行了如下探究。
探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由_____(填“固态”或“气态”)物质燃烧形成的。
探究二:物质燃烧产生火焰的根本原因是什么?
(查阅资料)
物质 | 熔点/℃ | 沸点/℃ | 燃烧时温度/℃ |
石蜡 | 50∽70 | 300∽550 | 约600 |
铁 | 1535 | 2750 | 约1800 |
钠 | 97.8 | 883 | 约1400 |
由上表可知:物质燃烧能否产生火焰与其_____(填“熔点”或“沸点”)和燃烧时温度有关。通过上表中石蜡、铁的数据对比,你认为物质燃烧时,什么情况下能产生火焰_____。
由此推测:钠在燃烧时,_____(填“有”或“没有”)火焰产生。
(拓展应用)根据硫在空气或氧气中燃烧的实验事实,请你推测硫的沸点_____硫燃烧时的温度(填“>”或“<”或“=”)。



