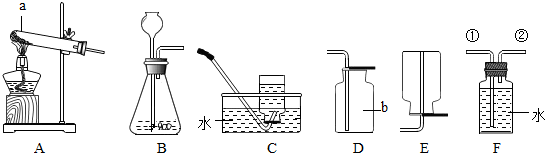
题目内容
19.现有氯酸钾与二氧化锰的混合粉末28.5g加热到不再产生氧气为止,冷却,称量得到固体残留物18.9g.试回答:(1)生成氧气的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(2)生成氧气的质量为9.6g;
(3)根据氧气的质量求解氯化钾质量(X)的比例式为$\frac{149}{96}=\frac{x}{9.6g}$;
(4)原固体粉末中氧酸钾的质量为24.5;
(5)生成氯化钾占所得固体的质量分数为78.9%;
(6)反应后所得固体中二氧化锰的质量为4g;
(7)反应后所得固体中氯化钾与二氧化锰的质量比为149:40.
分析 反应前后的质量差即为反应生成氧气的质量,根据氧气的质量可以计算氯化钾的质量、反应的氯酸钾的质量,进一步可以计算二氧化锰的质量等.
解答 解:(1)加热氯酸钾与二氧化锰的混合粉末生成了氯化钾和氧气,反应的化学方程式:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(2)生成氧气的质量为:28.5g-18.9g=9.6g;
(3)设生成的氯化钾的质量为x,氯酸钾的质量为y,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 149 96
y x 9.6g
$\frac{245}{96}=\frac{y}{9.6g}$ 解得:y=24.5g
求解氯化钾质量(X)的比例式为:$\frac{149}{96}=\frac{x}{9.6g}$ 解得:x=14.9g
(4)由以上计算可知,原固体粉末中氧酸钾的质量为24.5g;
(5)生成氯化钾占所得固体的质量分数为:$\frac{14.9g}{18.9g}×100%$≈78.9%;
(6)二氧化锰的质量为:18.9g-14.9g=4g;
(7)反应后所得固体中氯化钾与二氧化锰的质量比为:14.9g:4g=149:40
答案:(1)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;(2)9.6g;(3)$\frac{149}{96}=\frac{x}{9.6g}$;(4)24.5g;(5)78.9%;
(6)4g;(7)149:40.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性

练习册系列答案
相关题目
14. 小鹏与小明做完酸、碱、盐相关性质实验后,很感兴趣地把稀硫酸、氢氧化钠溶液和碳酸钠溶液混合一起,看到有大量气泡生成.他们对反应后溶液中溶质的成分很好奇,请你与他们一起进行探究.
小鹏与小明做完酸、碱、盐相关性质实验后,很感兴趣地把稀硫酸、氢氧化钠溶液和碳酸钠溶液混合一起,看到有大量气泡生成.他们对反应后溶液中溶质的成分很好奇,请你与他们一起进行探究.
【提出问题】反应后溶液中溶质的成分是什么?
【猜想假设】猜想①Na2SO4、Na2CO3; 猜想②Na2SO4、H2SO4; 猜想③Na2SO4;
猜想④Na2SO4、H2SO4、Na2CO3;猜想⑤Na2SO4、Na2CO3、NaOH.
上述猜想中,你认为不合理的是猜想④(填序号).
【资料查询】Na2SO4溶液呈中性.
【实验探究】(1)小鹏取少量该溶液于试管中,向其中滴加无色酚酞,发现溶液颜色无变化,据此,他认为猜想③是正确的.你认为他的结论是不合理(填“正确”或“不正确”)的,理由是Na2SO4、H2SO4也不能使无色酚酞变色.
(2)小明向盛有少量氧化铜粉末的试管中加入适量该溶液,振荡,溶液变蓝.该反应的化学方程式是CuO+H2SO4═CuSO4+H2O.
【实验结论】根据上述实验探究,你认为猜想②(填序号)是正确的.
【总结与反思】工厂与实验室的酸性废水必须处理至中性再排放,这样做的意义是减少水的污染.(答一点即可)
【定量研究】取27g纯碱样品(由Na2CO3和NaCl组成),平均分成五份.将它们依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g)(如图),每次充分反应后都进行称量,得到的实验数据如表:
计算:
(1)第一次加入纯碱样品充分反应后,生成二氧化碳的质量.
(2)纯碱样品中碳酸钠的质量分数.(计算结果精确到0.1%)
(3)所用稀盐酸的质量分数.
 小鹏与小明做完酸、碱、盐相关性质实验后,很感兴趣地把稀硫酸、氢氧化钠溶液和碳酸钠溶液混合一起,看到有大量气泡生成.他们对反应后溶液中溶质的成分很好奇,请你与他们一起进行探究.
小鹏与小明做完酸、碱、盐相关性质实验后,很感兴趣地把稀硫酸、氢氧化钠溶液和碳酸钠溶液混合一起,看到有大量气泡生成.他们对反应后溶液中溶质的成分很好奇,请你与他们一起进行探究.【提出问题】反应后溶液中溶质的成分是什么?
【猜想假设】猜想①Na2SO4、Na2CO3; 猜想②Na2SO4、H2SO4; 猜想③Na2SO4;
猜想④Na2SO4、H2SO4、Na2CO3;猜想⑤Na2SO4、Na2CO3、NaOH.
上述猜想中,你认为不合理的是猜想④(填序号).
【资料查询】Na2SO4溶液呈中性.
【实验探究】(1)小鹏取少量该溶液于试管中,向其中滴加无色酚酞,发现溶液颜色无变化,据此,他认为猜想③是正确的.你认为他的结论是不合理(填“正确”或“不正确”)的,理由是Na2SO4、H2SO4也不能使无色酚酞变色.
(2)小明向盛有少量氧化铜粉末的试管中加入适量该溶液,振荡,溶液变蓝.该反应的化学方程式是CuO+H2SO4═CuSO4+H2O.
【实验结论】根据上述实验探究,你认为猜想②(填序号)是正确的.
【总结与反思】工厂与实验室的酸性废水必须处理至中性再排放,这样做的意义是减少水的污染.(答一点即可)
【定量研究】取27g纯碱样品(由Na2CO3和NaCl组成),平均分成五份.将它们依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g)(如图),每次充分反应后都进行称量,得到的实验数据如表:
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入纯碱样品的质量/g | 5.4 | 5.4 | 5.4 | 5.4 | 5.4 |
| 电子天平的示数/g | 163.2 | 166.4 | 169.6 | 175 | 180.4 |
(1)第一次加入纯碱样品充分反应后,生成二氧化碳的质量.
(2)纯碱样品中碳酸钠的质量分数.(计算结果精确到0.1%)
(3)所用稀盐酸的质量分数.
 甲、乙两种固体纯净物的溶解度曲线如图A所示.
甲、乙两种固体纯净物的溶解度曲线如图A所示. A~G都是初中化学中常见的物质,已知B为黑色固体,C为胃酸主要成分,F和G为植物光合作用的原料.A、B、C、D、E分别为五种不同类别的物质,它们的转化关系如图所表(“一”表示相互能反应,“一”表示有转化关系).请回答:
A~G都是初中化学中常见的物质,已知B为黑色固体,C为胃酸主要成分,F和G为植物光合作用的原料.A、B、C、D、E分别为五种不同类别的物质,它们的转化关系如图所表(“一”表示相互能反应,“一”表示有转化关系).请回答:
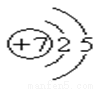 ,请你根据以下各元素的原子结构示意图判断,与氮元素具有相似化学性质的是 ( )
,请你根据以下各元素的原子结构示意图判断,与氮元素具有相似化学性质的是 ( )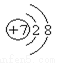 B.
B.  C.
C.  D.
D.