题目内容
2.金属钼可用于制造火箭、导弹等耐高温材料.如果钼铅矿(PbMoO4)中的铅元素为+2价,则钼元素的化合价为( )| A. | +2 | B. | +3 | C. | +4 | D. | +6 |
分析 根据在化合物中正负化合价代数和为零,结合钼铅矿的化学式进行解答即可.
解答 解:铅元素为+2价,氧元素显-2价,设钼元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+x+(-2)×4=0,则x=+6价.
故选:D.
点评 本题难度不大,掌握利用化合价的原则(化合物中正负化合价代数和为零)计算指定元素的化合价的方法即可正确解答此类题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列说法正确的是( )
| A. | 高炉炼铁中所需的高温和CO的生成都与焦炭有关 | |
| B. | 为了加强食品的色、香、味,可以大量使用添加剂 | |
| C. | 洗洁精能够洗去餐具上的油污,因为洗洁精能够溶解油污 | |
| D. | 饱和澄清石灰水受热后变浑浊,因为氢氧化钙的溶解度随温度升高而增大 |
10.“分类”可以使人们有序的研究物质,以下分类正确的是( )
| A. | 合金:生铁、纯铁、青铜 | B. | 碱:纯碱、烧碱、消石灰 | ||
| C. | 盐:碳酸钙、氯化钠、氯化银 | D. | 合成材料:塑料、合成纤维、铝合金 |
14.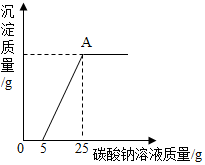 为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①②③④),每份样品分别与一定量的稀盐酸反应,所得数据如下表所示:
为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①②③④),每份样品分别与一定量的稀盐酸反应,所得数据如下表所示:
然后,为了探究石灰石与稀盐酸反应后所得废液中的溶质成分,将编号 ③所得废液过滤,取滤液质量的$\frac{1}{4}$于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:分析题中有关信息和图象,回答下列问题:
(1)石灰石样品的纯度为80%.
(2)图象中5-25阶段发生的反应方程式是CaCl2+Na2CO3═CaCO3↓+2NaCl.
(3)编号③所用稀盐酸的质量m为85g (要写计算过程)
 为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①②③④),每份样品分别与一定量的稀盐酸反应,所得数据如下表所示:
为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①②③④),每份样品分别与一定量的稀盐酸反应,所得数据如下表所示:| 样品编号 | ① | ② | ③ | ④ |
| 稀盐酸的质量 | 20g | 40g | m(80<m<130)g | 130g |
| 剩余固体的质量 | 8g | 6g | 2g | 2g |
(1)石灰石样品的纯度为80%.
(2)图象中5-25阶段发生的反应方程式是CaCl2+Na2CO3═CaCO3↓+2NaCl.
(3)编号③所用稀盐酸的质量m为85g (要写计算过程)
11.2014年,我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图.下列关于水的说法中正确的是( )

| A. | 团簇中的水分子不再运动 | B. | 氢、氧两种元素只能组成水 | ||
| C. | 水蒸气冷凝成水,分子间隔减小 | D. | 0℃时冰的密度比液态水的密度大 |
 临近中午她饿了,她打开了自带的即热饭盒,其内部结构如图所示.需要加热食物时,让盒内的水与生石灰接触即可,此反应的化学方程式为CaO+H2O=Ca(OH)2.
临近中午她饿了,她打开了自带的即热饭盒,其内部结构如图所示.需要加热食物时,让盒内的水与生石灰接触即可,此反应的化学方程式为CaO+H2O=Ca(OH)2. 烧开水的炊壶往往有一层很厚的水垢,水垢的主要成分是CaCO3和Mg(OH)2,为了弄清水垢中碳酸钙的质量分数,取一定质量经干燥后的样品置于烧杯中,向烧杯中滴加一定溶质质量分数的稀盐酸,实验测得烧杯中物质的总质量与加入盐酸的质量关系如图所示.求:
烧开水的炊壶往往有一层很厚的水垢,水垢的主要成分是CaCO3和Mg(OH)2,为了弄清水垢中碳酸钙的质量分数,取一定质量经干燥后的样品置于烧杯中,向烧杯中滴加一定溶质质量分数的稀盐酸,实验测得烧杯中物质的总质量与加入盐酸的质量关系如图所示.求: