题目内容
在CO与CO2的混合气体中,碳元素的含量为36%,现有10g混合气体通过足量的灼热的氧化铜粉末,将所得气体再通入足量澄清的石灰水中,最后可得沉淀多少?
- A.无法计算
- B.10g
- C.20g
- D.30g
D
分析:根据题意,混合气体通过足量的灼热的氧化铜粉末后全部变为二氧化碳,求出混合气体中一氧化碳的质量即可计算出全部转化为二氧化碳时的质量,由二氧化碳的质量根据反应的化学方程式可计算生成沉淀的质量.
由混合气体中碳元素的质量分数是36%,根据两气体中碳元素的质量分数,可计算10g混合气体中一氧化碳的质量.
解答:设10g混合气体中一氧化碳的质量为m,则二氧化碳质量为10g-m
m× ×100%+(10g-m)×
×100%+(10g-m)× ×100%=10g×36%
×100%=10g×36%
解得m=5.6g
设5.6g一氧化碳与氧化铜完全反应生成二氧化碳的质量为x
CO+CuO Cu+CO2
Cu+CO2
28 44
5.6g x
 =
=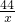 x=8.8g
x=8.8g
10g混合气体通过足量的灼热的氧化铜粉末后,二氧化碳气体质量=8.8g+(10g-5.6g)=13.2g
设生成沉淀的质量为y
CO2+Ca(OH)2═CaCO3↓+H2O
44 100
13.2g y
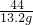 =
= y=30g
y=30g
故选D.
点评:本题的核心是计算出混合气体中一氧化碳的质量,根据混合气体中碳元素质量分数解决混合气体中的一氧化碳质量,使得问题即可迎刃而解.
分析:根据题意,混合气体通过足量的灼热的氧化铜粉末后全部变为二氧化碳,求出混合气体中一氧化碳的质量即可计算出全部转化为二氧化碳时的质量,由二氧化碳的质量根据反应的化学方程式可计算生成沉淀的质量.
由混合气体中碳元素的质量分数是36%,根据两气体中碳元素的质量分数,可计算10g混合气体中一氧化碳的质量.
解答:设10g混合气体中一氧化碳的质量为m,则二氧化碳质量为10g-m
m×
 ×100%+(10g-m)×
×100%+(10g-m)× ×100%=10g×36%
×100%=10g×36%解得m=5.6g
设5.6g一氧化碳与氧化铜完全反应生成二氧化碳的质量为x
CO+CuO
 Cu+CO2
Cu+CO228 44
5.6g x
 =
=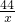 x=8.8g
x=8.8g10g混合气体通过足量的灼热的氧化铜粉末后,二氧化碳气体质量=8.8g+(10g-5.6g)=13.2g
设生成沉淀的质量为y
CO2+Ca(OH)2═CaCO3↓+H2O
44 100
13.2g y
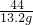 =
= y=30g
y=30g故选D.
点评:本题的核心是计算出混合气体中一氧化碳的质量,根据混合气体中碳元素质量分数解决混合气体中的一氧化碳质量,使得问题即可迎刃而解.

练习册系列答案
相关题目
在CO与CO2的混合气体中,碳元素的含量为36%,现有10g混合气体通过足量的灼热的氧化铜粉末,将所得气体再通入足量澄清的石灰水中,最后可得沉淀多少?( )
| A、无法计算 | B、10g | C、20g | D、30g |