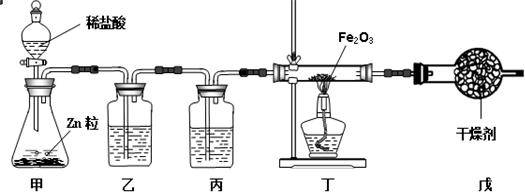
题目内容
点燃3.7g氢气和氧气的混合气体,充分反应后冷却至室温,剩余气体0.1g,则原混合气体的成分可能是( )
| A、0.3gH2 3.4gO2 | B、0.4gH2 3.3gO2 | C、0.5gH2 3.2gO2 | D、0.6gH2 3.1gO2 |
分析:3.7g氢气和氧气的混合气体充分反应后剩余气体0.1g,则参加反应的气体的质量为3.6g;其中氢气与氧气的质量比可根据反应的化学方程式进行确定;而剩余的气体可能是氢气也可能是氧气;参加反应的气体与剩余气体的质量和为原混合气体是该气体的质量.
解答:解:根据反应的化学方程式2H2+O2
2H2O可得知恰好完全反应时,参加反应的气体中H2与O2的质量比=4:32=1:8;
由题意可知,参加反应氢气与氧气的质量之和为3.6克,则参加反应H2的质量=3.6g×
=0.4g,则参加反应的O2的质量=3.6g-0.4g=3.2g;而剩余的0.1g气体可能为H2也可能为O2;
(1)假设剩余气体为氧气,则氧气质量为3.3克,氢气质量为0.4克;
(2)假设剩余气体为氢气,则氧气质量为3.2克,氢气质量为0.5克;
故选BC.
| ||
由题意可知,参加反应氢气与氧气的质量之和为3.6克,则参加反应H2的质量=3.6g×
| 1 |
| 9 |
(1)假设剩余气体为氧气,则氧气质量为3.3克,氢气质量为0.4克;
(2)假设剩余气体为氢气,则氧气质量为3.2克,氢气质量为0.5克;
故选BC.
点评:反应的化学方程式中各物质的质量比,即恰好完全反应时各物质的质量关系.

练习册系列答案
相关题目
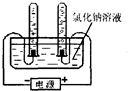 29、小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题:
29、小华是个非常爱动脑的同学,做溶液的导电性实验时,小华观察得非常仔细,以下是他们小组观察、记录并思考的一些问题: