题目内容
10.已知某NaCl样品中含有Na2CO3杂质,为测定样品中杂质的质量分数,同学们通过交流后达成共识:加入某种物质与样品中的Na2CO3反应,通过测量某一生成物的质量来计算Na2CO3的质量,从而测定出样品中杂质的质量分数.于是探讨出如下的实验方案:【方案一】:取一定量样品配成溶液后,滴加足量的CaCl2溶液,测量生成沉淀的质量.
(1)生成的白色沉淀是碳酸钙,所滴加的CaCl2溶液要足量的原因是将Na2CO3完全反应掉.
(2)测量生成沉淀的质量:对反应后的混合物进行过滤(填一实验操作名称)、洗涤、烘干、称量.
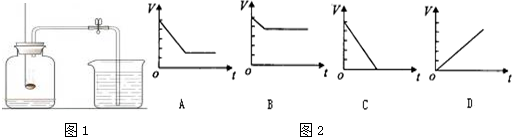
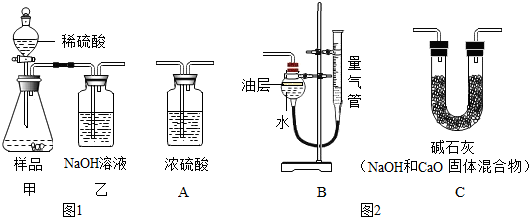
【方案二】:往一定量样品中滴加足量的稀硫酸,测量生成CO2的质量.实验装置如图1:(不考虑其他因素的影响)
(3)样品与稀硫酸反应的化学方程式:H2SO4+Na2CO3═Na2SO4++H2O+CO2↑,
(4)装置中NaOH溶液的作用是吸收二氧化碳.
(5)如果将分液漏斗中的稀硫酸换成稀盐酸,测定的Na2CO3含量会偏高(选填“偏高”、“偏低”或“不变”).
(6)对装置图1中乙装置部分的改造可行的是图2中B(填序号).
【方案三】:如果让你选择与上述不同类别的物质来实验,你会选用足量的氢氧化钙溶液来与Na2CO3反应.
【拓展】欲除去NaCl样品中含有的Na2CO3杂质,最好选用的试剂是D(填序号).
A.水 B.稀硫酸 C.CaCl2溶液 D.稀盐酸.
分析 【方案一】:碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,所滴加的CaCl2溶液要足量是将Na2CO3完全反应掉,过滤可以分离固体和液体;
【方案二】:碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳;氢氧化钠溶液可以吸收二氧化碳;盐酸具有挥发性;
【方案三】:根据复分解反应的条件分析;
【拓展】除杂时注意不能引入新的杂质;
解答 解:【方案一】:(1)碳酸钠与氯化钙反应生成碳酸钙沉淀,所以沉淀为碳酸钙;滴加的CaCl2溶液要足量是将Na2CO3完全反应掉;
(2)过滤可以分离固体和液体;
故答案为:(1)碳酸钙;将Na2CO3完全反应掉;(2)过滤;
【方案二】:(3)碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,反应的化学方程式为:H2SO4+Na2CO3═Na2SO4++H2O+CO2↑;
(4)氢氧化钠溶液可以吸收二氧化碳,用于计算.
(5)如果将分液漏斗中的稀硫酸换成稀盐酸,盐酸具有挥发性,挥发出的氯化氢气体一同被氢氧化钠吸收,测定的Na2CO3含量会偏高;
(6)A、浓硫酸不能吸收二氧化碳,故错误;
B、中油层防止二氧化碳溶于水,右侧的量气筒可以测出二氧化碳的体积,故可行;
C、中碱石灰会吸收空气中的二氧化碳和水蒸气,造成测定的Na2CO3含量会偏高,故错误;
故答案为:(3)H2SO4+Na2CO3═Na2SO4++H2O+CO2↑;(4)吸收二氧化碳;(5)偏高;(6)B;
【方案三】:方案一中使用了盐,方案二中使用了酸,所以不同类别的物质可选碱,与Na2CO3反应,可以用氢氧化钙或氢氧化钡溶液;故答案为:氢氧化钙或氢氧化钡;
【拓展】A、NaCl和Na2CO3都溶于水,无法除去杂质;
B、H2SO4+Na2CO3═Na2SO4++H2O+CO2↑,引入了新的杂质Na2SO4;
C、CaCl2溶液少了不能出去Na2CO3,过了本身会成为杂质,可行,但不是最理性的;
D、加入过量稀盐酸,出去Na2CO3,之后蒸发结晶即可.
故选:D.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | 反应物是水,生成物是氢气和氧气,反应条件是通电 | |
| B. | 每2份质量的水完全反应可生成2份质量的氢气和1份质量的氧气 | |
| C. | 反应物和生成物的分子个数比为2:2:1 | |
| D. | 生成的氢气和氧气的质量比为4:32 |
| A. |  稀释浓硫酸 | B. |  过滤 | C. |  点燃酒精灯 | D. |  存储氢气 |
| A. | 钙 | B. | 镁 | C. | 铜 | D. | 锌 |