题目内容
20.将12.5g石灰石放入100g稀盐酸中,石灰石的主要成分与盐酸恰好完全反应(杂质不反应也不溶解),过滤得不饱和滤液和2.5g滤渣.试计算:(1)大理石中碳酸钙的质量分数;
(2)稀盐酸中溶质的质量分数;
(3)反应后所得溶液中溶质的质量分数.
分析 因为反应时杂质不会参与反应,所以恰好反应后剩余的杂质即为大理石中杂质的质量,据此可知样品中碳酸钙的质量;利用方程式以及碳酸钙的质量可以求出反应的氯化氢质量,进而可得稀盐酸的质量分数;根据生成的氯化钙质量以及所得溶液的质量即可求出反应后所得溶液中溶质的质量分数.
解答 解:(1)根据反应后滤渣的质量为2.5g,所以大理石中碳酸钙的质量为12.5g-2.5g=10g,则大理石中碳酸钙的质量分数为:$\frac{10g}{12.5g}$×100%=80%;
(2)设反应的氯化氢质量是x 生成的氯化钙的质量是y,二氧化碳的质量是z
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 111 44
10g x y z
则$\frac{100}{10g}=\frac{73}{x}=\frac{111}{y}=\frac{44}{z}$,解得x=7.3g,y=11.1g,z=4.4g
稀盐酸的质量分数为:$\frac{7.3g}{100g}$×100%=7.3%
(3)反应后所得溶液的质量是10g+100g-4.4g=105.6g,则反应后所得溶液中溶质的质量分数为$\frac{11.1g}{105.6g}$×100%≈10.5%.
答:(1)大理石中碳酸钙的质量分数为80%;(2)稀盐酸的质量分数为7.3%;(3)反应后所得溶液中溶质的质量分数为10.5%.
点评 根据反应的化学方程式进行计算时,所使用的质量均为纯净物的质量,不纯物质的质量不能直接代入化学方程式进行计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列试剂中,能把稀盐酸、NaOH溶液、Ca(OH)2溶液一次性鉴别出来的是( )
| A. | 石蕊试液 | B. | 酚酞试液 | C. | Na2CO3溶液 | D. | CuSO4溶液 |
5.将CO气体通过灼热的氧化铜粉末.则下列描述不正确的是( )
| A. | CO具有氧化性 | B. | 氧化铜被还原 | ||
| C. | 看到黑色粉末变为光亮的红色物质 | D. | 澄清石灰水变浑浊 |
12.下列气体中,属于纯净物的是( )
| A. | 洁净的空气 | B. | 结冰的水 | C. | 矿泉水 | D. | 香烟的烟气 |
9.推理是化学学习中常用的思维方法.下列推理正确的是( )
| A. | 中和反应生成盐和水,所以生成盐和水的反应都是中和反应 | |
| B. | 单质是由一种元素组成的,所以有一种元素组成的纯净物一定是单质 | |
| C. | 碱能跟非金属氧化物反应,所以碱溶液一定能吸收二氧化碳和一氧化碳气体 | |
| D. | 碳酸盐和酸反应有气泡产生,所以和酸反应有气泡产生的一定是碳酸盐 |
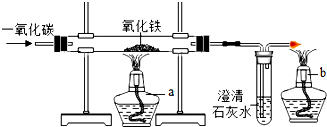
2.铁矿石冶炼成铁是一个复杂的过程.炼铁的原理是利用一氧化碳与氧化铁的反应,该化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(1)某化学兴趣小组在实验室中模拟炼铁原理的实验,并对固体产物的成分进行探究.
【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如图,酒精灯b的作用是点燃多余的一氧化碳,避免污染空气.
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g).
②反应后玻璃管和内盛黑色固体的总质量m(冷却到室温称量).
(2)检测A中的产物是否含铁的化学方法是取样,在A中的产物中滴加稀硫酸;如果产生气泡;则含有铁(写出操作、现象、结论).
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色.小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料.
【查阅资料】
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关.
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁.
③
【进一步实验和得出结论】
①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和氧化亚铁.
②该小组同学将黑色固体粉末投入硫酸铜溶液中,一段时间后无紫红色固体析出,则该黑色固体粉末为四氧化三铁.其实,进行如上图所示实验后,若测得反应后玻璃管和内盛黑色固体的总质量m为65.8g,也能得出这个结论.
【反思与评价】一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间.上图所示实验装置中,应作的一处修改是将酒精灯a换成酒精喷灯.
(3)当Fe2O3反应完全后,应先熄灭酒精喷灯,继续通一氧化碳直到装置中的固体冷却
(4)某同学实验完成后,发现过量的澄清石灰水增重0.44g,则该同学通人装置的CO气体质量>(填“>”、“<”或“=”)0.28g.理由是实验开始或结束都要通入一氧化碳.
(1)某化学兴趣小组在实验室中模拟炼铁原理的实验,并对固体产物的成分进行探究.
【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如图,酒精灯b的作用是点燃多余的一氧化碳,避免污染空气.

【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g).
②反应后玻璃管和内盛黑色固体的总质量m(冷却到室温称量).
(2)检测A中的产物是否含铁的化学方法是取样,在A中的产物中滴加稀硫酸;如果产生气泡;则含有铁(写出操作、现象、结论).
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色.小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料.
【查阅资料】
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关.
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁.
③
| 物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和氧化亚铁.
②该小组同学将黑色固体粉末投入硫酸铜溶液中,一段时间后无紫红色固体析出,则该黑色固体粉末为四氧化三铁.其实,进行如上图所示实验后,若测得反应后玻璃管和内盛黑色固体的总质量m为65.8g,也能得出这个结论.
【反思与评价】一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间.上图所示实验装置中,应作的一处修改是将酒精灯a换成酒精喷灯.
(3)当Fe2O3反应完全后,应先熄灭酒精喷灯,继续通一氧化碳直到装置中的固体冷却
(4)某同学实验完成后,发现过量的澄清石灰水增重0.44g,则该同学通人装置的CO气体质量>(填“>”、“<”或“=”)0.28g.理由是实验开始或结束都要通入一氧化碳.