题目内容
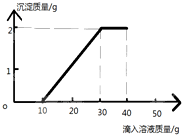
11. 某实验小组取实验室制备CO2后所得的50.0g废液(含有CaCl2和HCl)于烧杯中,向其中加入溶质质量分数为10%的碳酸钠溶液,测得生成沉淀质量与所加入的碳酸钠溶液的质量关系如图.计算:
某实验小组取实验室制备CO2后所得的50.0g废液(含有CaCl2和HCl)于烧杯中,向其中加入溶质质量分数为10%的碳酸钠溶液,测得生成沉淀质量与所加入的碳酸钠溶液的质量关系如图.计算:(1)生成沉淀的质量5g
(2)该废液中含CaCl2的质量分数.
分析 根据所加入的碳酸钠溶液首先与混合溶液中的盐酸发生反应,待盐酸完全反应后继续和氯化钙进行反应;由变化曲线图可知,所加入的碳酸钠溶液有5g与盐酸发生反应、10g与氯化钙溶液发生反应;根据反应的化学方程式,由碳酸钠的质量分别计算氯化钙的质量.
解答 解:(1)由图示可知,反应所生成的沉淀质量为5.0g;
(2)设所取混合溶液氯化钙的质量分别为x,
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106 100
x 5g
$\frac{111}{x}$=$\frac{100}{5g}$
x=5.55g
所以废液中含CaCl2的质量分数为:$\frac{5.55g}{50g}$×100%=11.1%.
故答案为:(1)5;
(2)11.1%.
点评 变化曲线的起点是前一个反应恰好完全反应的终点也是后一个反应的起点,曲线折点则是与此曲线相关反应的终点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.写出下列溶液中的溶质、溶剂或溶液的名称:
| 溶液 | 盐酸 | 澄清石灰水 | 碘酒 | ||
| 溶质 | 氯化钠 | 氢氧化钠 | |||
| 溶剂 | 水 | 水 |
6. 如图所示,向小试管中分别加入下列一定量的物质,右侧U型管中的液面未发生明显变化,该物质是( )
如图所示,向小试管中分别加入下列一定量的物质,右侧U型管中的液面未发生明显变化,该物质是( )
 如图所示,向小试管中分别加入下列一定量的物质,右侧U型管中的液面未发生明显变化,该物质是( )
如图所示,向小试管中分别加入下列一定量的物质,右侧U型管中的液面未发生明显变化,该物质是( )| A. | 浓硫酸 | B. | 氢氧化钠固体 | C. | 硝酸铵 | D. | 食盐固体 |
16.请你调查一下身边的金属材料制成的物品,并观察它们的颜色状态,以及查找有关资料,填写下表.
| 金属材料 | 所含元素种类(具体名称) | 颜色 | 状态 | 硬度 | 其它用途 | |
| 1 | ||||||
| 2 |
1.下列物质中一定是氧化物的是( )
| A. | 由氧元素和另一种元素组成的物质 | |
| B. | 含氧元素的化合物 | |
| C. | 一种化合物受热分解后生成氧气和一种金属,该化合物一定是氧化物 | |
| D. | 氧气跟某些物质反应的生成物 |




 某班同学完成制取二氧化碳的实验后,对回收的盐酸和氯化钙混合溶液(不考虑其他杂质)进行了以下实验:取62.44g该混合溶液于烧杯中,向烧杯中滴入溶质质量分数为13.8%K2CO3溶液40克.滴入K2CO3溶液质量与生成沉淀质量的关系如图所示.求:
某班同学完成制取二氧化碳的实验后,对回收的盐酸和氯化钙混合溶液(不考虑其他杂质)进行了以下实验:取62.44g该混合溶液于烧杯中,向烧杯中滴入溶质质量分数为13.8%K2CO3溶液40克.滴入K2CO3溶液质量与生成沉淀质量的关系如图所示.求: 化学物质间的反应除了观察和记录外,也需要从分子、原子角度进行想象和分析,这就产生了用模型来模拟化学变化.我们用○和●分别代表两种不同元素的原子,该元素组成的单质在一定条件下能发生以下反应.已知○的相对原子质量是●的a倍,反应前后的模拟模型如图所示:
化学物质间的反应除了观察和记录外,也需要从分子、原子角度进行想象和分析,这就产生了用模型来模拟化学变化.我们用○和●分别代表两种不同元素的原子,该元素组成的单质在一定条件下能发生以下反应.已知○的相对原子质量是●的a倍,反应前后的模拟模型如图所示: 的质量比为a:3:(a+3)(用含a的式子表示).
的质量比为a:3:(a+3)(用含a的式子表示).