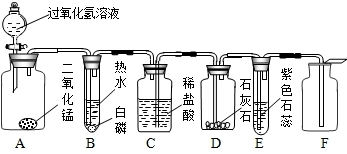
��Ŀ����
ijͬѧģ����������ѧ���ġ�������·�������������������ȡ��������֤�����ʵ�顣��Һ©��������A�г��ִ������ݣ�B�а���ȼ�գ�C��Һ���½����뿴ͼ�ش����⣺

A B C D E F
(1) A�з�Ӧ�Ļ�ѧ����ʽΪ�� ��
��2��B�а����ܹ�ȼ�յ�ԭ���� ��
(3) D�е�ʵ�������� ��
��Ӧ�Ļ�ѧ����ʽΪ ��
(4) E�е�ʵ�������� ��
��Ӧ�Ļ�ѧ����ʽΪ ��
(5) ��Fװ���ռ������������ ��
��6�����ô���ʯ��ϡ���ᷴӦ��ȡ������̼���壬��Ӧ�����Ķ�����̼���������������ϡ�����������ϵ��ͼ��ʾ������ʾ������ʯ�е����ʲ�������Ӧ��������ܽ���Բ��ƣ���ϡ���������ʵ����������Ƕ��٣�

��1��2H2O2 MnO2 2 H2O + O2��
��2���������Ӵ����¶ȴﵽ�Ż�㡣
��3��C��Һ�����D�У������ݲ����� CaCO3 + 2HCl���� CaCl2 + H2O + CO2��
��4�����ܿ�������ð������Һ����ɫ���ɫ�� CO2 + H2O���� H2CO3
��5��������ܶȱȿ����ܶȴ�
��6��10%
������������1��������֪����Ӧ��˫��ˮ��������ˮ����������Ӧ����Ϊ�������̣���
2H2O2 MnO2 2 H2O + O2����
��2��B�а����ܹ�ȼ�յ�ԭ���ǰ����¶ȴﵽ�Ż�㣬�������Ӵ���
��3������������C���������ѹ��D��ʯ��ʯ��Ӧ���ɶ�����̼����Ӧ�Ļ�ѧ����ʽΪ��CaCO3+2HCl�TCaCl2+H2O+CO2����
��4��������̼�������E����ˮ��Ӧ����̼�ᣬ��ɫʯ��������ɫ����Ӧ�Ļ�ѧ����ʽΪ��CO2+H2O=H2CO3
��5����Fװ���������ſ��������ʺ��ռ��ܶȱȿ���������壬���ռ�����������������ܶȱȿ����ܶȴ�
��6���⣺��ϡ����������HCl������ΪX
CaCO3 + 2HCl ���� CaCl2 + H2O + CO2��
2��36.5 44
X 2.2g
2��36.5 /44 =X/ 2.2g ������������������1�֣�
X =3.65 g ������������������1�֣�
ϡ����������HCl����������Ϊ��3.65g /36.5g g��100% =10% ����������1�֣�
��ϡ����������HCl����������Ϊ10 %��

 ��У����ϵ�д�
��У����ϵ�д�