题目内容
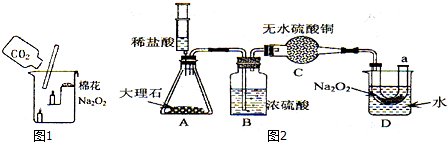
19.根据下列图示装置回答问题:
(1)写出仪器名称a酒精灯 b试管
(2)实验室欲用双氧水制取并收集氧气,应选用发生装置B和收集装置C、E(填编号)连接.用双氧水制氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;基本类型为分解反应.
(3)若用高锰酸钾制取较纯的氧气,选择的制取装置是A、E,当O2收集满并取出集气瓶后,停止该实验的正确操作方法是先将导管撤离水槽,然后熄灭酒精灯.
(4)若要制取二氧化碳,选择的发生装置是B,将气体通入澄清石灰水,如澄清石灰水变浑浊,则为二氧化碳,收集装置C,实验室制取二氧化碳的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑,如何检验二氧化碳?请写出有关操作和现象将气体通入澄清石灰水,如澄清石灰水变浑浊,则为二氧化碳.
(5)小华同学用浓HCl与大理石在C装置中反应,制取CO2并检验其有关性质,观察到烧杯中紫色石蕊试液变红,对这一现象的解释不合理是a(填序号).
a.产生的CO2直接使石蕊试液变红
b.产生的CO2与H2O反应生成H2CO3,使石蕊试液变红
c.挥发出的氯化氢溶于水,使石蕊试液变红.
分析 酒精灯是常用的加热仪器,试管是常用的反应容器;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,用排水法收集的氧气比较纯净.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳.
解答 解:(1)酒精灯是常用的加热仪器,试管是常用的反应容器,故答案为:酒精灯;试管;
(2)如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平,属于分解反应;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;故答案为:B,C、E,2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,分解反应;
(3)如果用高锰酸钾制氧气就需要加热,氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,用排水法收集的氧气比较纯净;当O2收集满并取出集气瓶后,停止该实验的正确操作方法是:先将导管撤离水槽,然后熄灭酒精灯;故答案为:A、E,先将导管撤离水槽,然后熄灭酒精灯.
(4)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;故答案为:B,C,CaCO3+2HCl═CaCl2+H2O+CO2↑,将气体通入澄清石灰水,如澄清石灰水变浑浊,则为二氧化碳.
(5)用浓HCl与大理石在C装置中反应,制取CO2并检验其有关性质,观察到烧杯中紫色石蕊试液变红,对这一现象的解释不合理是:产生的CO2直接使石蕊试液变红;故答案为:a.
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、气体的性质和注意事项等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

 阅读快车系列答案
阅读快车系列答案| A. |  检查气密性 | B. |  溶解固体 | C. |  倾倒液体 | D. |  收集气体 |
(1)[问题]Al2O3能不能作过氧化氢分解的催化剂呢?
(2)[猜想]Al2O3能作过氧化氢分解的催化剂.
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 取1支试管加入过氧化氢溶液,然后用带火星的木条伸入试管中 | 木条不复燃 | 常温下过氧化氢溶液不分解 |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 木条复燃 | Al2O3能加快过氧化氢的分解速率 |
(4)[结论]Al2O3能加快过氧化氢的分解速率,故Al2O3能作过氧化氢分解的催化剂.
(5)[讨论与反思]经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验:
实验三:[实验目的]探究Al2O3在反应前后质量是否改变
[实验步骤]①准确称量Al2O3(少量)的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤,干燥,称量;④对比反应前后Al2O3的质量.
[讨论]如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂.
(6)但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验:
探究Al2O3的化学性质在反应前后是否改变.
| A. | 限制使用塑料袋──节约资源 | B. | 石墨能导电──可作电极 | ||
| C. | 开采海底石油──开发新能源 | D. | 二氧化碳能与水反应──人工降雨 |

| A. | 该反应属于分解反应 | |
| B. | 参加反应的两种分子的个数比为5:1 | |
| C. | 该反应前后所有元素的化合价都没有变化 | |
| D. | 不考虑反应条件,该图示可表示氢气燃烧的反应 |
| 实验过程 组别 | 实验目的 | 所加试剂 (或操作) | 实验现象 | 实验结论 |
| A | 检验面包是否有淀粉 | 碘酒溶液 | 变蓝色 | 面包含有淀粉 |
| B | 除去NaCl中的 少量Na2CO3 | 稀盐酸 | 有气泡产生 | Na2CO3已被除完 |
| C | 区分硬水和蒸馏水 | 肥皂水 | 产生 泡沫较少 | 该液体为蒸馏水 |
| D | 用排空气法收集二氧化碳并检验集气瓶中氧气是否集满 | 将燃烧的木条伸人瓶中 | 木条熄灭 | 瓶中二氧化碳已集满 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 颜色、状态 | B. | 熔点、沸点 | C. | 腐蚀性、可燃性 | D. | 密度、硬度 |
| A. | 食物变馊 | B. | 鞭炮爆炸 | C. | 冰雪融化 | D. | 铁生锈 |