题目内容
【题目】下列图像能正确反映所对应叙述关系的是( )

A.①图表示一定量的木炭还原氧化铜,剩余固体质量与反应时间的关系图
B.②是用CO还原CuO来测定CuO中铜元素的含量
C.图③是一定质量的氯酸钾和二氧化锰制氧气时,二氧化锰的质量分数(a%)随时间(t)变化的曲线图
D.图④是用适量的KC1O3和MnO2混合物加热制O2
【答案】A
【解析】
A、木炭还原氧化铜会生成金属铜和二氧化碳气体,原来的固体是木炭和氧化铜,反应生成的固体是金属铜,随着反应地进行固体的质量应有所减少,当反应停止时,固体的质量不会再减少,故A正确;
B、用一氧化碳还原CuO生成铜和水,参加反应的氧化铜的质量和生成铜的质量比为5:4,而不是如图所示,故B错误;
C、一定质量的氯酸钾和二氧化锰制氧气时,由于有氧气放出,而二氧化锰作为催化剂,质量不变,所以剩余固体质量会减少,因此二氧化锰的质量分数(a%)随时间(t)进行逐渐增大最后为一定值,故C错误;
D、用适量的KClO3和MnO2混合物加热制O2,不能一加热就放出氧气,需要加热到一定温度时才能放出氧气,故D错误。
故选A。

【题目】焦炭(主要成分是碳单质,杂质不与水反应) 与水蒸气在高温条件下反应,能产生一种俗称为水煤气的气体燃料,可能还有H2、CO、CO2.某小组同学设计了如下实验装置并进行实验。实验后发现 A 装置中溶液变浑浊,D 中的固体由黑色变红色,E 中的固体由 白色变蓝色,G 装置中有水流入烧杯。(已知无水硫酸铜遇水蒸气变蓝,碱石灰能吸收二氧化碳和水蒸气,浓硫酸能吸收水蒸气)。
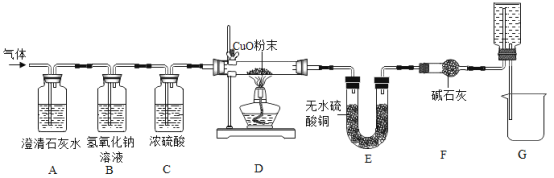
在反应前后对D、E装置进行了质量的测量(各步反应均完全),测量结果如表:
装置及药品 | 反应前 | 反应后 |
D装置中玻璃管与固体的总质量/g | 223.3 | 215.0 |
E装置中U型管与固体的总质量/g | 260.0 | 267.2 |
请分析回答下列问题:
(1)水煤气中一定含有CO2的理由是_____(用化学方程式表示)。
(2)一定能证明水煤气中有氢气存在的实验现象是_____,_____。
(3)G 装置的作用:①“抽气”;②_____。
(4)该小组同学通过数据分析,证明水煤气中存在 CO 气体,请利用上表中的原始数据,列出数据分析过程(只列式不计算)。_____
(5)同学们发现,不通过测量反应前后装置的质量,也可方便的证明 CO 气体的存在。 需增加一个图中的装置_____(填装置序号)来代替装置 F。
【题目】用如图所示的装置进行实验,验证质量守恒定律。
| 实验1 | 实验2 | ||
实验药品 | 硫酸铜溶液、铁 | 过氧化氢溶液、二氧化锰 | ||
电子秤示数 | 反应前 | m1 | m3 | |
反应后 | m2 | m4 | ||
(1)实验2发生反应的化学方程式为____________________________。
(2)实验2中药品混合后,烧杯内可观察到的现象为___________________。
(3)比较反应前后电子秤示数,描述正确的是__________(填序号)。
Am1=m2 Bm1<m2 Cm3= m4 Dm3> m4