题目内容
18.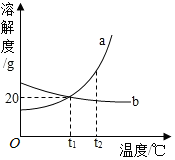 如图是a、b两种物质的溶解度曲线图.根据图中信息判断,下列说法正确的是( )
如图是a、b两种物质的溶解度曲线图.根据图中信息判断,下列说法正确的是( )| A. | a的溶解度大于b的溶解度 | |
| B. | 将t2℃时的a、b两物质的饱和溶液降温到t1℃,都有晶体析出 | |
| C. | t1℃时,a、b的溶解度都为20 g | |
| D. | b物质的不饱和溶液温度升高后一定能变成饱和溶液 |
分析 根据题目信息和溶解度曲线可知:a固体物质的溶解度,是随温度升高而增大,而b的溶解度随温度的升高而减少;a的溶解度大于b的溶解度错误,因为没有指明温度;将t2℃时的a、b两物质的饱和溶液降温到t1℃,都有晶体析出错误,b没有晶体析出,因为b的溶解度随温度的升高而减少;t1℃时,a、b的溶解度都为20g正确,因为它们在该温度下有交点;b物质的不饱和溶液温度升高后一定能变成饱和溶液错误,不是一定.
解答 解:A、a的溶解度大于b的溶解度错误,因为没有指明温度;故选项错误;
B、将t2℃时的a、b两物质的饱和溶液降温到t1℃,都有晶体析出错误,b没有晶体析出,因为b的溶解度随温度的升高而减少;故选项错误;
C、t1℃时,a、b的溶解度都为20g正确,因为它们在该温度下有交点;故选项正确;
D、b物质的不饱和溶液温度升高后一定能变成饱和溶液错误,不是一定,故选项错误;
故选C
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液结晶的方法等,本考点主要出现在选择题和填空题中.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
6.下列关于分子的叙述中不正确的是( )
| A. | 我们不能直接看到空气中各种气态分子的存在,说明分子很小 | |
| B. | 将气态的C4H10液化,其分子的大小会发生了变化 | |
| C. | 无色气体和有色气体能够自动均匀混合,说明分子在不停地运动 | |
| D. | 空气中和纯净氧气中的氧分子化学性质完全相同 |
3.下列过程属于物理变化的是( )
| A. | 光合作用 | B. | 石油分馏 | C. | 钢铁生锈 | D. | 高炉炼铁 |
10.KNO3和KCl在不同温度时的溶解度曲线如图所示,下列说法正确的是( )

| A. | 温度低于40℃时,KNO3的溶解度一定小于KCl的溶解度 | |
| B. | 将等质量的KNO3和KCl的饱和溶液从60℃降温到20℃,析出晶体的质量KNO3大于KCl | |
| C. | 将10℃时KNO3、KCl的饱和溶液升温至60℃,KNO3溶液中溶质的质量分数比KCl大 | |
| D. | 将20℃时100gKCl的饱和溶液升温至60℃,需要再加入11.5gKCl固体才能使溶液恰好饱和 |
7.为检验塑料片中是否含有碳元素,可选用下列哪些实验仪器( )

| A. | ②③④ | B. | ①②③ | C. | ①② | D. | ②④ |
8.错误的说法是( )
| A. | 水银不是银 | B. | 盐酸不是酸 | C. | 干冰不是冰 | D. | 纯碱不是碱 |
