题目内容
【题目】化学兴趣小组的同学们探究用Fe从含Fe2(SO4)3和CuSO4的溶液中获取金属Cu的原理.请你一起参与探究.
(1)实验依据:金属活动顺序.请在下表对应的方框内填入铁和铜的元素符号. ![]()
意外发现:小明将光亮的铁丝插入含Fe2(SO4)3和CuSO4的废液中,一段时间后取出,意外地发现铁丝表面没有变红.
提出问题:Fe为什么没有从废液中置换出Cu?
提出假设:小丽认为在铁丝表面可能有Cu析出,但被Fe2(SO4)3溶液溶解了.
验证假设:提供的主要实验用品:洁净的铁丝和铜丝各两根,相同体积、相同浓度的Fe2(SO4)3溶液三份[Fe2(SO4)3溶液显黄色].
实验操作 | 实验现象和数据 | 结论 |
①准确称量洁净的铁丝和铜丝的质量 | 铁丝质量为ag, | \ |
②将铁丝插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、称量 | 铁丝质量为mg,(m<a),溶液有黄色变为浅绿色 | 一定有生成(填化学式) |
③将铜丝插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、称量 | 铜丝质量为ng(n<b) | 铜(填“能”或“不能”)与Fe2(SO4)3溶液反应 |
④另取相同质量、相同粗细的洁净铁丝和铜丝互相缠绕,插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、分别称量铁丝和铜丝的质量 | 铁丝质量较轻 | Fe、Cu共存时优先与Fe2(SO4)3溶液反应 |
(2)实验结论:小丽的假设(选填“成立”或“不成立”),理由是;
(3)思考与交流: ①兴趣小组的同学们通过对上述实验的分析,找到了用Fe从含Fe2(SO4)3和CuSO4的溶液中提取金属Cu的关键,并且最终实验获得了成功,其实验成功的关键是: . 并且反应充分.
②已知Fe和Fe2(SO4)3发生化合反应.请按反应顺序写出用Fe从含Fe2(SO4)3和CuSO4的溶液中获取金属Cu的化学方程式:; .
【答案】
(1)Fe、Cu;FeSO4;能;Fe
(2)不成立;Fe、Cu共存时Fe优先与Fe2(SO4)3溶液反应
(3)加入过量的铁;Fe+Fe2(SO4)3=3FeSO4;Fe+CuSO4=FeSO4+Cu
【解析】解:(1)熟记金属活动性顺序表,并会写元素符号,所以答案是:Fe Cu;②根据反应后铁丝的质量减少了,并且溶液由黄色变为浅绿色,确定为硫酸亚铁溶液,所以答案是:FeSO4③将铜丝插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、称量,铜丝质量为ng(n<b),铜能与Fe2(SO4)3溶液反应,所以答案是:能;④根据实验后的现象“铁丝质量较轻,铜丝质量不变”得知Fe、Cu共存时Fe优先与Fe2(SO4)3溶液反应,所以答案是:Fe;(2)用Fe从含Fe2(SO4)3和CuSO4的溶液中获取金属Cu,实验过程Fe没有从废液中置换出Cu,小丽认为在铁丝表面可能有Cu析出,但被Fe2(SO4)3溶液溶解了.但是根据实验探究的结果发现Fe、Cu共存时Fe优先与Fe2(SO4)3溶液反应,所以小丽的假设错误的,所以答案是:不成立;Fe、Cu共存时Fe优先与Fe2(SO4)3溶液反应;(3)①根据实验探究的结果,我们得知铁先于硫酸铁溶液反应生成硫酸亚铁,所以只有加入过量的铁才能发生铁与硫酸铜溶液的置换反应,从而生成铜,所以答案是:加入过量的铁;②已知Fe和Fe2(SO4)3发生化合反应,且生成的是浅绿色的溶液;铁与硫酸铜溶液的反应属于置换反应是教材上学过的反应方程式,所以答案是:Fe+Fe2(SO4)3=3FeSO4 Fe+CuSO4=FeSO4+Cu
【考点精析】根据题目的已知条件,利用金属活动性顺序及其应用和书写化学方程式、文字表达式、电离方程式的相关知识可以得到问题的答案,需要掌握在金属活动性顺序里:1、金属的位置越靠前,它的活动性就越强2、位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)3、位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来.(除K、Ca、Na);注意:a、配平 b、条件 c、箭号.

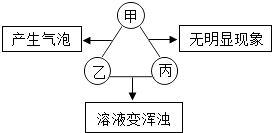
【题目】如表所列各组物质中,符合图示甲、乙、丙两两混合后发生反应的实验现象的是
甲 | 乙 | 丙 | |
① | 盐酸 | Na2CO3溶液 | Ca(OH)2溶液 |
② | 盐酸 | K2CO3溶液 | CaCl2溶液 |
③ | 盐酸 | K2CO3溶液 | Ba(OH)2溶液 |
④ | 盐酸 | Na2CO3溶液 | BaCl2溶液 |
( )
A.①②
B.③④
C.①③
D.①②③④