题目内容
含杂质3%的锌粒(杂质不与酸反应)与稀盐酸反应,制取氢气11.2升(标准状况下),则需该种锌粒________克,质量分数为15%稀盐酸________克.(标准状况下,1L氢气的质量是0.09克).
33.8 245.3
分析:根据锌与盐酸反应生成氯化锌与氢的化学方程式,由制取氢气的质量,求出消耗锌及HCl的质量,即可计算出需要含杂质锌粒及稀盐酸的质量.
解答:设消耗锌的质量为x、HCl的质量为y
Zn+2HCl═ZnCl2+H2↑
65 73 2
x y 11.2L×0.09g/L
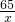 =
=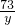 =
=
x=32.76g,y=36.79g
则需该种锌粒的质量=32.76g÷(1-3%)=33.8g
需质量分数为15%稀盐酸的质量=36.79g÷15%=245.3g
故答案为:33.8;245.3.
点评:根据反应的化学方程式进行计算时,所使用的物质的质量均为纯净物的质量,含杂质的物质的质量不能直接代入化学方程式进行计算.
分析:根据锌与盐酸反应生成氯化锌与氢的化学方程式,由制取氢气的质量,求出消耗锌及HCl的质量,即可计算出需要含杂质锌粒及稀盐酸的质量.
解答:设消耗锌的质量为x、HCl的质量为y
Zn+2HCl═ZnCl2+H2↑
65 73 2
x y 11.2L×0.09g/L
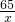 =
=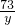 =
=
x=32.76g,y=36.79g
则需该种锌粒的质量=32.76g÷(1-3%)=33.8g
需质量分数为15%稀盐酸的质量=36.79g÷15%=245.3g
故答案为:33.8;245.3.
点评:根据反应的化学方程式进行计算时,所使用的物质的质量均为纯净物的质量,含杂质的物质的质量不能直接代入化学方程式进行计算.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目