题目内容
取等质量的X、Y、Z三种金属分别与足量同浓度的稀硫酸反应,都生成+2价硫酸盐,反应情况如图(相对原子质量Mg﹣24、Zn﹣65、Fe﹣56 )则正确叙述是( )

|
| A. | 金属活动性由强到弱:X、Y、Z | B. | 产生氢气质量:X>Y>Z |
|
| C. | X、Y、Z依次可能是Mg、Zn、Fe | D. | 反应所需时间:X<Y<Z |
| 在金属活动性顺序中,氢前的金属能与酸反应生成氢气,金属的位置越靠前,与酸反应的速率越快,在坐标中,斜线越陡,据此分析解答即可; | |
| 解答: | 解:A、据图可以看出,X的斜线最陡,反应的速率最快,Y的斜线最平缓,故的速率最慢,故其活动性为X>Z>Y,故A错误; B、据图可以看出,反应结束后X生成的氢气最多,Z生成的氢气最少,所以产生的氢气质量应为X>Y>Z,故B正确; C、在金属活动性顺序中,Mg>Zn>Fe,而由A的分析可知其活动性为X>Z>Y,故C错误; D、由图象的信息可知完全反应时X消耗的时间最短,Y消耗的时间最长,所以反应所需时间:X<Z<Y,故D错误; 故选B. |

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
 19、某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z粉末分别与足量的溶质质量分数相同的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况用右图来表示.下列顺序正确的是
19、某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z粉末分别与足量的溶质质量分数相同的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况用右图来表示.下列顺序正确的是 (2013?苍梧县二模)取等质量的X、Y、Z三种金属分别与足量同浓度的稀硫酸反应,都生成+2价硫酸盐,反应情况如图(相对原子质量Mg-24、Zn-65、Fe-56 )则正确叙述是( )
(2013?苍梧县二模)取等质量的X、Y、Z三种金属分别与足量同浓度的稀硫酸反应,都生成+2价硫酸盐,反应情况如图(相对原子质量Mg-24、Zn-65、Fe-56 )则正确叙述是( ) (2005?白下区一模)某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相等的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况如右图所示.下列对该图象理解的叙述中,正确的是( )
(2005?白下区一模)某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相等的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况如右图所示.下列对该图象理解的叙述中,正确的是( ) (2008?怀柔区二模)某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相同的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况用如图来表示.下列对该图象理解的叙述中,正确的是( )
(2008?怀柔区二模)某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相同的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况用如图来表示.下列对该图象理解的叙述中,正确的是( )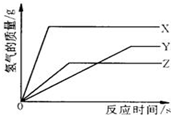 某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验,取等质量的X、Y、Z分别与足量的溶质质量分数相同的稀H2SO4反应,都生成+2价金属的硫酸盐,反应情况如图所示,下列对该图象理解的叙述中,正确的是( )
某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验,取等质量的X、Y、Z分别与足量的溶质质量分数相同的稀H2SO4反应,都生成+2价金属的硫酸盐,反应情况如图所示,下列对该图象理解的叙述中,正确的是( )